Więzy życia
Jednym z podstawowych zarzutów, jakie ewolucjonizmowi stawiają kreacjoniści, zwłaszcza ci, którzy w szkole przespali tylko lekcje biologii, a na fizyce niekiedy uważali, jest jej rzekoma niezgodność z zasadami termodynamiki.
Powtarzają więc do znudzenia: druga zasada termodynamiki stanowi, że entropia zawsze rośnie. Entropia, czyli termodynamiczna funkcja stanu wyrażająca nieuporządkowanie układu. Matematycznie wiąże się z liczbą możliwości zrealizowania danego układu. Jeśli mamy więc układ doskonale uporządkowany, jak np. żywy organizm bądź działające narzędzie, ma on wiele ograniczeń i można go zbudować na ograniczoną liczbę sposobów. Zepsuć go można natomiast na znacznie więcej: jednej całej szklance odpowiadają niezliczone możliwości rozbicia. Wobec tego rozbita szklanka ma większą entropię niż nierozbita. Dlatego obserwować będziemy samorzutne rozbijanie się szklanki, ale nie samorzutne jej składanie się z kawałków. Dopuszczalność danego procesu fizycznego wyznacza wzrost entropii. Kreacjoniści wyprowadzają z tego wniosek, jakoby niemożliwe było samorzutne powstanie organizmów żywych, złożonych, ściśle zorganizowanych struktur, posiadających przeto bardzo małą entropię.
Ci, którzy na fizyce uważali nie tylko niekiedy, dopowiedzą jednak do tego dwie rzeczy. Po pierwsze: nie zawsze entropia rośnie – w procesach równowagowych się nie zmienia. Po drugie – rośnie entropia całkowita. Inaczej mówiąc: entropia rośnie w układach zamkniętych. Jeżeli sztucznie wyizolujemy mentalnie część układu, entropia może w tej części maleć. Ktoś przecież musiał tę szklankę wyprodukować, lokalnie zmniejszając entropię.
Co więcej, natura ma pewne zdolności samoorganizacji. Zmieszane z wodą cząsteczki tłuszczu, zbudowane z polarnej, dobrze rozpuszczalnej w wodzie (hydrofilowej) główki i nierozpuszczalnego, „tłustego” (hydrofobowego) ogonka, tworzą bąble bądź powierzchnie z dwóch warstw cząsteczek. Tym razem forma, wydawałoby się, bardziej uporządkowana ma po prostu mniejszą energię – a tracąc energię, cząsteczki przekazują ją otoczeniu i całkowita entropia rośnie. Chemia fizyczna łączy entropię układu i otoczenia w innej funkcji stanu, entalpii swobodnej, wyznaczającej możliwość zajścia reakcji. Tak naprawdę życie istnieje dzięki Słońcu, które daje mu niską entalpię swobodną.
Zdolności układu do samoorganizacji opisuje w swojej książce „Świat poza fizyką. Powstanie i ewolucja życia” Stuart A. Kauffman, amerykański lekarz i biolog.
Rozpatruje on prosty proces fizyczny: podgrzewanie gazu. Ten ostatni oddaje energię otoczeniu, zwiększając jego ciepło. Może też poruszyć tłok, wykonując pracę. Oba procesy przebiegają dokładnie tak samo: rozgrzany gaz ma większą energię, a więc jego cząsteczki silniej (szybciej) uderzają w cząsteczki otoczenia. Co więc różnicuje pracę i ciepło? W tym pierwszym przypadku przesuwają tłok w jedną konkretną stronę. Ich bezładny ruch przesuwa tłok w tym jedynym kierunku, w którym może to zrobić. Cząsteczki uderzają w każdym kierunku, ale tylko w jednym mogą coś poruszyć. Występuje pewne zewnętrzne wobec nich samych ukierunkowanie. Jak pisze autor, na układ nałożono więzy. Podobnie w przypadku wystrzelającej pocisk armaty – ukierunkowanie ruchu kuli przez armatę (więzy) umożliwia wykonanie pracy.
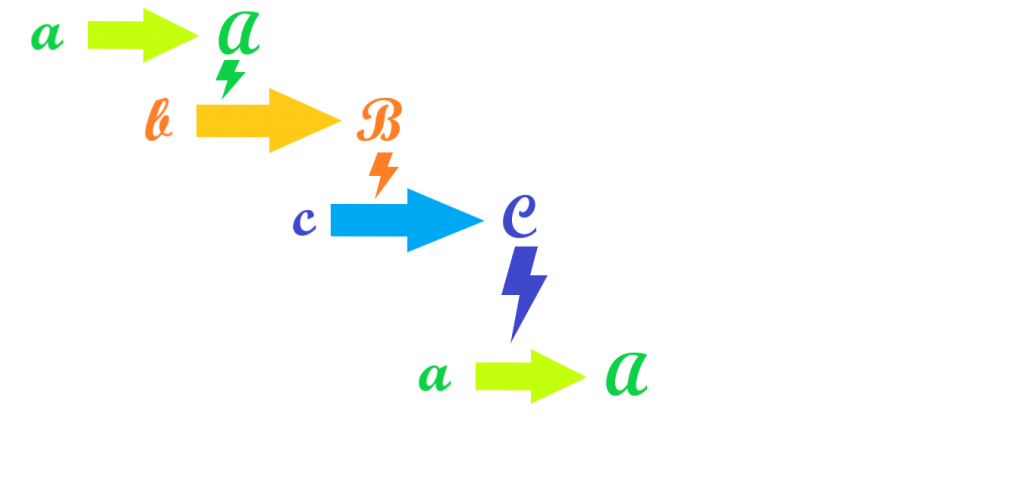
Kauffman stawia teraz pytanie: co jeśli wykonywana praca polegać będzie na tworzeniu właśnie więzów? Niekoniecznie więzów tego samego procesu. Może dostarczać więzów umożliwiających wykonanie innej pracy, również polegającej na tworzeniu więzów, dzięki którym wykonana zostanie kolejna praca, dostarczająca z kolei więzy pierwotnego procesu. Otrzymamy zamknięty cykl, który przy dopływie energii ukierunkuje się sam na podtrzymywanie swego istnienia, a nawet samopowielanie się.
Autor ukazuje następnie, że podobne pętle więzów mogą tworzyć się dość łatwo w niezbyt skomplikowanych mieszaninach substancji organicznych, jako że wiele prostych związków ma właściwości katalityczne (ukierunkowujące i ułatwiające przebieg innych reakcji, a więc dostarczające więzów). Kilkuetapowy układ wzajemnie katalizowanych reakcji syntezy samych katalizatorów (np. A katalizuje powstanie B, które katalizuje syntezę C, które katalizuje tworzenie A) będzie podtrzymywał swoje istnienie. I zarazem jest na tyle prosty, że może spontanicznie wyłonić się w roztworze.
Z czasem będzie on ulegał dalszym komplikacjom, włączał nowe katalizatory i reakcje, wszystkie zachodzące zgodnie z zasadami termodynamiki. Podawany przez kreacjonistów jako sztandarowy przykład nieredukowalnej złożoności (a więc układ, który z powodu swego skomplikowania nie mógł powstać stopniowo, gdyż żaden etap pośredni sam by się nie utrzymał) cykl Krebbsa zaobserwowano w zasadowych komórkach skalnych kominów hydrotermalnych, gdzie zachodzi bez żadnych organizmów żywych i żadnych białkowych katalizatorów. Zachodzi, bo składające się nań reakcje mają ujemną entalpię swobodną. Tak jak reakcje zachodzące w naszym organizmie, z tym że znacznie bardziej ukierunkowane licznymi więzami, które same wytwarzają.
Dostarczamy sobie energię i obniżamy entalpię swobodną, przyjmując pokarm. Dalej na każdym etapie jego obróbki i przetworzenia na budulec czy energię dochodzi do rozproszenia istotnej części energii w postaci ciepła, co zwiększa entropię otoczenia. Sumaryczna entropia wzrasta pomimo licznych procesów zwiększających lokalnie porządek. Ten wzrost można nawet wyliczyć. Jeśli się uważało na fizyce.
Marcin Nowak
Bibliografia
- Stuart A. Kauffman, Świat poza fizyką. Powstanie i ewolucja życia. Copernicus Center Press, Kraków 2019 / 2021
Ilustracja została wykonana przez autora
Komentarze
W przypadku entropii, jej definicja i wykładnia jest nie do końca precyzyjnie rozumiana. Entropia jest nie tyle miarą nieuporządkowania układu, ale miarą możliwości zapełnienia/osiągnięcia większej liczby stanów energetycznych. Entropia świata rośnie, bo rośnie możliwość powstawania i trwania coraz subtelniejszych stanów energetycznych. Na przykład, obniżenie temperatury sprzyja trwaniu coraz większej liczby możliwych struktur związków chemicznych opartych na atomie węgla. W konsekwencji, wzrost entropii sprzyja powstawaniu życia, jako subtelnego skomplikowanego układu molekuł organicznych.
Przykład ze szklanką wody wypełnioną w połowie olejem i wodą też wymaga pewnego doprecyzowania. Otóż, entropia jest większa w układzie gdzie dwie fazy, polarna i niepolarna (olej i woda) są rozdzielona, co jest sprzeczne z ogólnie pojmowanym pojęciem entropii. Dzieje się tak, ponieważ molekuły wody w fazie wymieszanej są zorganizowane wokół fazy mikrostruktur niepolarnego oleju. Pakują zatem olej w coraz większe struktury, bo objętość rośnie szybciej niż powierzchnia. Uwalniają w ten sposób kolejne molekuły wody, które mogą tworzy interakcje z innymi molekułami wody, aż powierzchnia styku faz osiągnie minimum. Właśnie w ten sposób następuje zwijanie się białek, poprzez upakowanie łańcucha niepolarnych reszt aminokwasowych przez wodę, a sekwencja, czyli kolejność tych reszt aminokwasowych, zapewnia unikalną trójwymiarową strukturę białka. To dzieje się samorzutnie i powtarzalnie. I to jest piękny przykład, który wykazuje że przysłowiowe powstawanie Boeninga ze złomowiska, jest li tylko chwytem erystycznym, mającym zniechęcić do myślenia.
Zapamiętałem komentarz do Teorii Oparina…..
W laboratorium możemy odtworzyc wszystkie znane elementy.
Z wyjątkiem jednego.
CZASU…
Samorzutne tworzenie się struktur białkowych, kodu genetycznego, jeszcze kilkadziesiąt lat temu było magią.
W miarę poznawania i nazywania nowych czynników składających się na cykl zycia, magia cofa się coraz dalej.
Ale, dla większości populacji dalej będzie magią, wymagającą boskiej interwencji.
Teoria entropii sprawdza się, jak na razie.
Niewykluczone że kiedyś zastąpiona zostanie inną.
Co przeciętnego zjadacza chleba niespecjalnie wzruszy.
Wśród Słowian więzy życia są silne …przerastają ludowe pod hasłem : Proletariusze wszystkich krajów łączcie się … ! Tak sobie myślę prywatnie … bez boskiej interwencji …
Ad definicja entropii dla maluczkich rozumem:
Otóż zgodnie z równością Clausiusa dla odwracalnego procesu cyklicznego, całka okrężna od mała delta Q(rev)/T = 0, a to znaczy, że całka liniowa od tegoż Q(rev)/T jest funkcją stanu, czyli funkcją zależną wyłącznie od stanu układu, czyli od aktualnych wartości jego parametrów, takich jak masa, liczność materii, temperatura, ciśnienie, objętość i inne a jej wartość z definicji nie zależy od jego historii, tzn. tego co działo się z nim wcześniej. Tak więc możemy zdefiniować funkcję stanu zwaną entropią, która spełnia warunek dS= mała deltaQ(rev)/T (używam tu opisowego języka, gdyż na tym blogu nie można ‘wyświetlić” np. symbolu całki).
Aby znaleźć różnicę entropii między dowolnymi dwoma stanami systemu, należy wiec obliczyć całkę dla pewnej odwracalnej ścieżki między stanem początkowym i końcowym Ponieważ entropia jest funkcją stanu, zmiana entropii systemu dla nieodwracalnej ścieżki jest taka sama jak dla odwracalnej ścieżki między tymi samymi dwoma stanami, jednak ciepło przekazywane do lub z oraz zmiana entropii otoczenia jest inna. Zmianę entropii możemy uzyskać jedynie całkując powyższy wzór. Aby uzyskać wartość bezwzględną entropii, potrzebujemy trzeciej zasady termodynamiki, która mówi, że S = 0 przy absolutnym zerze dla doskonałych kryształów.
Entropia jest to mierzalna właściwość fizyczna, która jest najczęściej powiązana ze stanem nieporządku (chaosu), losowości lub niepewności. Termin ten używany jest w różnych dziedzinach nauki – od klasycznej termodynamiki, gdzie po raz pierwszy została ona rozpoznana, do mikroskopowego opisu przyrody w fizyce statystycznej i teorii informacji (szerzej w cybernetyce). Znalazła ona szerokie zastosowanie w chemii i fizyce, w systemach biologicznych i ich związku z życiem, w kosmologii, ekonomii, socjologii, naukach o pogodzie, zmianach klimatu i systemach informacyjnych, w tym szczególnie w telekomunikacji. W roku 1865 niemiecki fizyk Rudolf Clausius, jeden z czołowych twórców termodynamiki, określił ją jako iloraz nieskończenie małej ilości ciepła do chwilowej temperatury. Początkowo opisał ją jako transformację, (w niemiecku Verwandlungsinhalt czyli „zawartość polimorficzna”), a później ukuł termin entropia z greckiego słowa oznaczającego transformację. Clausius zinterpretował tę koncepcję jako oznaczającą dysagregację. Dysagregacja została zdefiniowana w roku 1862 przez tegoż Clausiusa jako wielkość stopnia, w jakim cząsteczki ciała są od siebie oddzielone. Termin ten był wzorowany na pewnych fragmentach pracy francuskiego fizyka Sadi Carnota z roku 1824 „Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance” (po polsku znana jako „O sile poruszającej ognia”), w której scharakteryzowano „transformacje” tzw. „substancji roboczych” (cząstek układu termodynamicznego) cyklu silnika, a mianowicie „tryb agregacji”, które było prekursorem pojęcia „entropii”, słowa, które Clausius ukuł w roku 1865. Było to również prekursorem teorii entropii Ludwiga Boltzmanna z lat 1870-tych, wskazującej na różnorodność ruchów mikroskopijnych składników materii, opisanych w kategoriach „porządek” i „nieporządek” oraz koncepcji rozproszenia energii Guggenheima z roku 1949. Słowa „dysagregacja” i „rozproszenie” mają zresztą bliskie znaczenia.
Carnot wykazał, że praca wykonana przez maszynę parową jest wprost proporcjonalna do ilości ciepła, jaka przepływa z kotła do kondensatora i że ciepło jest w stanie wykonać pracę tylko przy przejściu z ciała cieplejszego do zimniejszego. Jest to cykl Carnota, który wraz z ograniczeniem Clausiusa stanowi drugą zasadę mechanicznej teorii ciepła, zwana też drugą zasadą termodynamiki. W notatkach ogłoszonych tuż po jego śmierci, Carnot wygłosił także zasadę równoważności ciepła i pracy.
A tu najistotniejsze w kontekście tej dyskusji:
Według Wikipedii, druga zasada termodynamiki jest to podstawowe prawo tejże termodynamiki, stwierdzające, że w układzie termodynamicznie izolowanym istnieje funkcja stanu, która nie maleje z czasem i zwana jest entropią. Oznacza się ją symbolem „S” (duża pochyła litera „S”). Zmiana czyli Delta (S) tej funkcji spełnia więc nierówność Delta (S) >= 0, przy czym równość (=) zachodzi wtedy i tylko wtedy, gdy proces jest odwracalny. Stosowana niekiedy uproszczona definicja: „w układzie termodynamicznie izolowanym w dowolnym procesie entropia nigdy nie maleje” jest zaś nieprawidłowa, gdyż jeśli układ jest daleki od stanu równowagi, to mimo że jest termodynamicznie izolowany, entropia może w nim przez pewien czas maleć. Takie zjawisko zachodzi w reakcjach oscylacyjnych. Uproszczenie w omawianej definicji jest zbyt daleko idące m. in. też dlatego, że entropia jest funkcją stanu, o której mowa w drugiej zasadzie termodynamiki tylko w układach bliskich równowagi – w przeciwnym razie dążenie do tego stanu jest dodatkowym czynnikiem pozwalającym na powstawanie struktur dyssypatywnych, a do utrzymania tych struktur niezbędna byłaby wymiana energii z otoczeniem, jednak czasowo mogą one powstawać także w układach izolowanych. Struktura dyssypatywna jest to zaś jedno z podstawowych pojęć termodynamiki układów nierównowagowych. Są to dalekie od stanu równowagi stabilne stany stacjonarne, których powstaniu towarzyszy wzrost uporządkowania. Do utrzymania tych struktur (stanów) niezbędna jest ciągła nieodwracalna wymiana energii z otoczeniem. Taka wymiana prowadzi do dyssypacji. Pojęcie struktur dyssypatywnych wiąże się z pojęciem samoorganizacji.
Także: Według II zasady termodynamiki każdy układ izolowany dąży do stanu równowagi, w którym entropia osiąga maksimum. Zakładając, że Wszechświat jako całość jest układem izolowanym, powinien on również dążyć do równowagi. Wychodząc z tych założeń, Hermann von Helmholtz wysunął hipotezę śmierci cieplnej Wszechświata, według której Wszechświat w końcu dojdzie do równowagi termodynamicznej, w której niemożliwa będzie zamiana energii cieplnej na pracę, przez co niemożliwy będzie rozwój Wszechświata. Stwierdzenie tego faktu jest jednak stosunkowo trudne do zaobserwowania i dlatego prowadzi się liczne dyskusje, czy Wszechświat jest, czy nie jest układem izolowanym, czy też tylko zamkniętym, oraz czy rzeczywiście dąży jako całość do równowagi. Przeciwnicy tej koncepcji są zdania, że rozszerzającego się Wszechświata nie można traktować jako układu izolowanego, gdyż nie można wyznaczyć obszaru, z którego nie wychodziłoby promieniowanie. Wiadomo jedynie, że entropia olbrzymiej większości znanych układów izolowanych rośnie w kierunku, który nazywamy przyszłością. Tak więc, z tego punktu widzenia, termodynamika określa kierunek upływu czasu (tzw. termodynamiczna strzałka czasu). Według Boltzmanna aktualna entropia Wszechświata jest jeszcze bardzo niska, w porównaniu z wartością „docelową”, na co dowodem miały być wysokie wartości fluktuacji statystycznych zjawisk obserwowanych w skali kosmosu – np. bardzo nierównomierne rozmieszczenie gwiazd w przestrzeni.
Clou:
Jeśli układ jest daleki od stanu równowagi, to mimo że jest termodynamicznie izolowany, entropia może w nim przez pewien czas maleć.
Nie mylmy entalpii z entropią!
Według Wikipedii (najłatwiej jest ją tu cytować), entalpia, czyli zawartość ciepła, jest funkcją stanu mająca wymiar energii, będąca też potencjałem termodynamicznym. Oznacza jest ona przez H, h lub χ a definiuje ją zależność: H=U+p*V, gdzie: H – entalpia układu, U – energia wewnętrzna układu, p – ciśnienie, V – objętość a * oznacza mnożenie (jak np. w Fortranie).
W termodynamice nie jest istotna wartość całkowitej entalpii, lecz tylko jej przyrost lub spadek w danym procesie. Przyrost entalpii występuje w sprężarkach, natomiast spadek w turbinach cieplnych. Moc maszyny przepływowej (turbiny, sprężarki) obliczana jest jako iloczyn wewnętrznego spadku (bądź przyrostu) entalpii czynnika przepływowego i strumienia masy rozprężanego (lub sprężanego) czynnika.
Natomiast entropiajest pojęciem szerszym gdyż jest to mierzalna właściwość fizyczna, która jest najczęściej powiązana ze stanem nieporządku (chaosu), losowości lub niepewności. Termin ten używany jest w różnych dziedzinach nauki – od klasycznej termodynamiki, gdzie po raz pierwszy została ona rozpoznana, do mikroskopowego opisu przyrody w fizyce statystycznej i teorii informacji (szerzej w cybernetyce). Znalazła ona szerokie zastosowanie w chemii i fizyce, w systemach biologicznych i ich związku z życiem, w kosmologii, ekonomii, socjologii, naukach o pogodzie, zmianach klimatu i systemach informacyjnych, w tym szczególnie w telekomunikacji. W roku 1865 niemiecki fizyk Rudolf Clausius, jeden z czołowych twórców termodynamiki, określił ją jako iloraz nieskończenie małej ilości ciepła do chwilowej temperatury. Początkowo opisał ją jako transformację, (w niemiecku Verwandlungsinhalt czyli „zawartość polimorficzna”), a później ukuł termin entropia z greckiego słowa oznaczającego transformację. Clausius zinterpretował tę koncepcję jako oznaczającą dysagregację. Dysagregacja została zdefiniowana w roku 1862 przez tegoż Clausiusa jako wielkość stopnia, w jakim cząsteczki ciała są od siebie oddzielone. Termin ten był wzorowany na pewnych fragmentach pracy francuskiego fizyka Sadi Carnota z roku 1824 „Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance” (po polsku znana jako „O sile poruszającej ognia”), w której scharakteryzowano „transformacje” tzw. „substancji roboczych” (cząstek układu termodynamicznego) cyklu silnika, a mianowicie „tryb agregacji”, które było prekursorem pojęcia „entropii”, słowa, które Clausius ukuł w roku 1865. Było to również prekursorem teorii entropii Ludwiga Boltzmanna z lat 1870-tych, wskazującej na różnorodność ruchów mikroskopijnych składników materii, opisanych w kategoriach „porządek” i „nieporządek” oraz koncepcji rozproszenia energii Guggenheima z roku 1949. Słowa „dysagregacja” i „rozproszenie” mają zresztą bliskie znaczenia.
Carnot wykazał, że praca wykonana przez maszynę parową jest wprost proporcjonalna do ilości ciepła, jaka przepływa z kotła do kondensatora i że ciepło jest w stanie wykonać pracę tylko przy przejściu z ciała cieplejszego do zimniejszego. Jest to cykl Carnota, który wraz z ograniczeniem Clausiusa stanowi drugą zasadę mechanicznej teorii ciepła, zwana też drugą zasadą termodynamiki. W notatkach ogłoszonych tuż po jego śmierci, Carnot wygłosił także zasadę równoważności ciepła i pracy.
Czas trwania obserwacji entropii, jest ograniczony długoscią życia obserwatora.
Ewentualnie, kilku ich pokoleń.
Czy na tej podstawie można wyciagać dalekosiężne wnioski?
Śmię wątpić….
Na dzień dzisiejszy dysponujemy jedynie szczątkową wiedzą o zjawiskach fizycznych, chemicznych, determinujących entropię.
Jej czas liczy się nie w mileniach tylko w eonach.
Po ich minięciu, będzie jeszcze jakis obserwator weryfikujący dane?
Przyznający rację jakiejś nieistniejącej już stronie sporu?
@kalvarya 17:04
Przepisane, z nieznacznymi tylko modyfikacjami, kolejno z następujących źrodeł:
https://hmn.wiki/pl/Entropy
https://polski.wiki/blog/en/Disgregation
https://www.duhoctrungquoc.vn/wiki/pl/Nicolas_L%C3%A9onard_Sadi_Carnot
Słowo “dysgregacja” zamienione w jednym miejscu na “dysagregację“- – to pewnie w ramach modyfikowania oryginału.
Nie będąc fizykiem bez specjalnego trudu wyłowiłam źródła, z których przepisujesz teksty przedstawiając je jako własne komentarze. Kogo chcesz oszukać skoro nawet laik może cię przyłapać na copy paste?
@kalvarya 18:26
Nie zauważyłeś, że większość tego tekstu przepisałeś w poprzednim komentarzu? Serwujesz jakieś gotowce bez sprawdzania co dokładnie zawierają?
@wiesiek59
29 MAJA 2022
Głównie przyznajemy rację matematyce, która stoi za dzisiejszą fzyką
Redes22 29 MAJA 2022 18:53
To jest tu na temat.
Marcin Nowak 29 MAJA 2022 19:01
Matematyka wprowadziła chaos do fizyki, np. wedlug obliczeń zgodnych z metodami matematycznymi, masa elektronu powinna byc nieskończona, podobnie jak jego energia. Frank Close, profesor fizyki teoretycznej i uznany jej popularyzator, w książce „Zagadka nieskończoności”, to wyjaśnia. Jeżeli bowiem mówimy o mikroświecie, to zapewne mowa jest o wielkościach nieskończenie małych, takich właśnie, jak np. elektron. Nie ma tam zatem miejsca na prawdziwie wielkie nieskończoności. One tam się jednak pojawiają. Matematyka sobie z nimi radzi, ale fizyka – nie. Wielkości występujące w równaniach mogą “uciekać” do nieskończoności, a tymczasem wielkości fizyczne, masa, ładunek elektryczny, temperatura, i tak dalej, muszą być skończone. Nawet słoń czy wieloryb nie może być nieskończenie wielki. Co jednak zrobić, gdy w równaniu opisującym własności materii i pojawia się nieskończoność?
Od strony fizycznej wygląda to mniej więcej tak: badamy własności elektronu zderzając go np. z innymi elektronami. Elektrony są obdarzone ładunkiem elektrycznym, a jednakowe ładunki się odpychają. Im szybciej rozpędzimy jeden naprzeciw drugiego, tym bardziej się do siebie zbliżą, po czym rozbiegną w przeciwne strony. W takim wysokoenergetycznym zderzeniu może zajść wiele innych zjawisk, ale najprostszy wariant jest opisany powyżej. Przy zderzeniu dwu kul bilardowych najmniejsza odległość między ich środkami jest równa sumie promieni kul i odpowiada momentowi zetknięcia powierzchni kul. Okazuje się, że elektron (wiele innych cząstek również) nie ma jednak powierzchni i można go traktować jako punkt, czyli np. można się do niego zbliżyć dowolnie blisko, jeżeli tylko dysponujemy dostatecznie dużą energią. Równanie opisujące zachowanie punktowego ładunku elektrycznego sformułowane przez Paula Diraca aż 85 lat temu okazało się niezwykle skuteczne w wyjaśnieniu bardzo wielu zjawisk w świecie atomowym, ale miało jedną zasadniczą wadę – przewidywało występowanie nieskończonych wielkości fizycznych w bezpośrednim otoczeniu elektronu. W ujęciu klasycznym punktowy ładunek wytwarza bowiem nieskończenie wielkie natężenie pola elektrycznego. Z takim polem wiąże się energia, która też okazuje się nieskończona, a z nią nieskończona masa. W fizyce kwantowej punktowy elektron prowadzi do nieskończenie silnego oddziaływania elektronu z wirtualnymi cząstkami emitowanymi i absorbowanymi przez niego samego, jak i pojawiającymi się i znikającymi nieustannie w próżni. W skali makroskopowej te nieskończoności w oczywisty sposób się nie ujawniają, a efektywnie mierzone masa i ładunek elektronu pozostają małe. Fizycznie oznacza to, że duże wielkości czegokolwiek, które występują w znikomym obszarze wokół elektronu wzajemnie się znoszą. A ściślej, niemal znoszą, gdyż pozostaje drobna różnica, którą obserwujemy jako elektron. Postawione na dwóch szalach słonie czy wieloryby mogą się dokładnie równoważyć, a jeżeli się nieco różnią, lżejszemu wystarczy dodać relatywnie niewielki odważnik, by uzyskać stan idealnego zbalansowania. Tak więc fizycy wymyślili niezgodną z zasadą Ockhama procedurę usuwania z równań nieskończoności, nazywaną renormalizacją.
Z matematycznego punktu widzenia sytuacja nie jest tu jednak komfortowa, gdyż nieskończoność nie jest dużą liczbą różniącą się od innej liczby o ileś tam. Nie można zatem od jednej nieskończoności po prostu odjąć drugiej. Z drugiej jednak strony, po renormalizacji równania pozwalają obliczyć wiele wielkości, które można również zmierzyć. Otrzymane wyniki pasują do siebie idealnie, tzn. zgadzają się za sobą z dokładnością ograniczoną jedynie przez dokładność obserwacji, ale kosztem naruszenia reguł matematyki i naruszenia reguły Ockhama.
Ponadto: elektrodynamika kwantowa opisuje niezmiernie precyzyjnie oddziaływania elektromagnetyczne. To jej zawdzięczamy całą domową elektronikę. Na co dzień i bezpośrednio odczuwamy działanie siły grawitacji, która w mikroświecie wydaje sie być mało znacząca, za to w skalach dużych i bardzo dużych odgrywa role dominującą. Ale w przyrodzie istnieją jeszcze dwa inne oddziaływania: tzw. słabe i silne, czyli jądrowe. Choć zasięg tych sił ogranicza się do mikroświata, ich skutki są wszechobecne również w skalach makro. Sukcesy elektrodynamiki zachęciły fizyków do poszukiwań wyjaśnienia pozostałych oddziaływań. Zamierzenie jest to ambitne i z tego względu niektórzy powstanie jednolitej teorii czterech oddziaływań nazywają Ogólną Teorią Wszystkiego (OTW, nie mylić z Ogólną Teorią Grawitacji Einsteina). Zapewne szybko taka teoria nie powstanie, ale na drodze ku niej zanotowano pierwszy znaczący sukces. W latach 1960-tych została stworzona teoria opisująca wspólnie odziaływania słabe i elektromagnetyczne. Dołączenie do niej oddziaływań jądrowych nazwano Teorią Wielkiej Unifikacji, ale na tę teorię również musimy jeszcze poczekać. Dlaczego trwa to tak długo? Odpowiedź znajdziemy w Zagadce nieskończoności. Close przedstawia historię odkryć i odkrywców ostatnich kilkudziesięciu lat szczegółowo i po kolei. A o kolejność wcale nie jest tu łatwo, gdyż poszukiwania to w wielu przypadkach błądzenie albo odkrywanie poszczególnych kawałków układanki przez dwóch, trzech i więcej fizyków w tym samym czasie, często z użyciem różnych formalizmów matematycznych.
Matematyka w fizyce oddziaływań elementarnych stanowi jedyny użyteczny język i wszelkie próby przełożenia praw fizyki na język popularny najczęściej prowadzą albo do nieporozumień, albo stanowią uproszczenie trywializujące całe zagadnienie. Myślę, że Frank Close jest świadom, że nie ma dobrej odpowiedzi na postawione w pierwszym akapicie pytanie o jakość popularyzacji. Dlatego równolegle z pojęciami matematycznymi, jak renormalizacja, niezmienniczość cechowania, czy bozon wektorowy (jest nim np. kwant światła) Close opowiada o ludziach, którzy te pojęcia stworzyli, manipulowali nimi w równaniach, by ostatecznie otrzymać wynik, który można było porównać z pomiarami wykonanymi przez innych fizyków. Choć fizyka jest w książce Close’a bardzo ważna, to fizycy nie stanowią w niej a jedynie tła i nie pojawiają się tylko w przypisach.
Link: http://users.camk.edu.pl/soltan/ciekawe_ksiazki/book_close_zagadka_nieskonczonosci.html
Redes22 29 MAJA 2022 18:42
Podałem źródła, a poza tym, to jest dyskusja na popularyzującym naukę blogu a nie artykuł do pisma naukowego.
Redes22 29 MAJA 2022 18:42
Znów tylko ad personam a nie ad rem. ;-(
@kalvarya01
Podałem źródła, a poza tym, to jest dyskusja na popularyzującym naukę blogu a nie artykuł do pisma naukowego.
Nie podałeś źródeł, bo powiedzieć “wg Wikipedii” bez odnośnego linku, po czym kopiować z innych opracowań nie wspominając o nich, podawaniem źródeł nie jest. Nie jest też żadną dyskusją wklejanie tekstów encyklopedycznych luźno związanych z tematem wpisu gospodarza.
Redes22 29 MAJA 2022 19:59
Znów off-topic i ad personam. Poza tym to na popularnonaukowym blogu wystarczy podać jako źródło Wikipedię. I nie ma sensu „odkrywanie” tego, co dawno temu zostało już odkryte. Nie zachowuj się też tu jak przekupka z Bazaru Różyckiego z czasów jego świetności. ;-)
I co na to „nasz” Dezerter? Jakie jest w tej sprawie oficjalne stanowisko sekty jehowitów?
„Nie może istnieć szansa bez „beneficjenta” – dla którego jest szansą.”
„(…)Patryk jest niszą i szansą dla Roberta.
Robert jest niszą dla Sławka, a Sławek
ze swoim klejem staje się częścią niszy dla Patryka.
A Patryk jest niszą dla Gucia.
Nie ma tu klina wbijanego w ciasne podstawy natury.(…)”
źródło:
Stuart A. Kauffman
Świat poza fizyką. Powstanie i ewolucja życia
„Więzi życia” – tytułowe, to takie od ucha do ucha Gospodarskie,
wracać i się siebie wzajemnie czepiać?! co zapanuje tu stary ład
i porządek…
i jeścio off – ale wybaczony, jakie wszystkie byłe i te przyszłe!!:
/> /\/\
https://www.youtube.com/watch?v=MzGnX-MbYE4
”Nie zachowuj się też tu jak „przekupka” z Bazaru „:
Przekupka…hm?!
Jak mnie cosik prze… to se misy jednonożnej w łazience
dosiadam!
Radzę zebrać kleksy, wirtualnie siem podetrzeć, i udać
w wyższe krzaczory!!!
Ten Blog, ma sobie przypisane i wierne linie papilarne
z klawiszy to tu i tam, lubi być muskany palcami, nie tępo
obrzucany wyklejanką!
Bohatyrowiczowa 29 MAJA 2022 20:56
Poza tym, to dlaczego odstawiłaś lekarstwa?
AAA „odstawiłaś”siem…!?
Żadna odstawiona, od urodzenia pełna wdzięku i polotu,
a kwasem hialuronowym luftuje się, …już z rzadka!
Kibel z wodą już w ryncach trzymom!
Zwarz co godosz! i do kogo!?
5,3 = 28
7,6 = 55
4,5 = 21
3,8 = ?
Bardzo fajne trafilem przypadkowo w sieci.
Boha nie dawaj tego synowi, prosze. Jestem pewien, ze rozwiaze.
To haczyk na tluste ryby, ktore pojawily sie w tym stawie.
Taka weryfikacja Turinga.
R. S.
pol litra (0,5) na pieciu, slabo
duza butla (1,5) whisky na szesciu, troche lepiej,
galon wina na siedemnastu ujdzie na chwile.
@ R.S.
29 MAJA 2022
21:15
Testy Turinga bylyby na niektorych forach bardzo przydatne 🙂
Szczegolnie takie bardziej zaawansowane. Bo czasami wydaje mi sie, ze ktos dla testu podlacza do forow jakies jeszcze niedorozwiniete wersje sztucznej inteligencji 😉
Jezeli twoj test jest z sieci, to kalvaryja (Czestochowska?) tez to pewno znajdzie. Bo watpie zeby sam znalazl rozwiazanie 😉
Moze mu ten przyklad pomoze :
1,1 = 2
A moze go te liczby pierwsze tylko zmyla 😉
PS. kalvaryja to po stylu wpisow chyba wczesniejszy Jakowalski (znawca S.Lema).
Orch OR
Powstanie zycia to powstanie swiadomosci. Swiadomosc istnieje w malych formach protoswiadomosci. Protoswiadomosc jest blokowana przez gazy anestetyczne. Ten sam gaz co usypia czlowieka robi to samo z pantofelkiem. Czy gaz anestetyczny zapobiega komunikacji bakterii i wirusow z otoczeniem nie wiem. Pierwsze zywe organizmy musialy reagowac na otoczene. Ta reakcja to swiadomosc. Kontakt z otoczeniem jest odpowiedzia na zagadke zycia na Ziemii. Kontakt ten nie jest dostepny do badania obecnymi metodami fizyki kwantowej. Mozemy domyslac sie jego istnienia tak samo jak John Snow i Ignac Semmelweis domyslali sie istnienia bakterii. Polecam teorie Penrose Hameroff Orch OR.
Slawomirski 30 MAJA 2022 2:47
To NIE są teorie, to są tylko psudo- lub jeśli wolisz, para-naukowe hipotezy. I nie ma też żadnej zagadki życia na Ziemi (tej pisanej przez jedno „i” na końcu), gdyż ono istnieje, na 100% w naszych umysłach.
Szalom!
R.S. 29 MAJA 2022 21:15
Odpowiedź jest 17, ale to oparte jest na swoistych regułach przekształceń i błędnym użyciu symbolu „=”. Coś jak rozwiązywanie równań transcendentnych. ;-)
A na serio, to mamy tyle matematyk, a więc i arytmetyk, ilu mamy wybitnych matematyków, np. matematyki bez zer (starorzymska) i bez nieskończoności (jak poprzednio), tyle, że one się na ogół NIE sprawdzają w praktyce. Wyjątkami potwierdzającymi tę regułę są np. matematyka z liczbami urojonymi czy też rachunek różniczkowy i całkowy oparty de facto na dzieleniu przez zero. 😉 A już taki np. rachunek prawdopodobieństwa, to nam bardziej mąci w głowach niż cokolwiek wyjaśnia. ;-)
@Slawomirski
30 MAJA 2022
Znowu?
Zwracam uwagę dyskutujących na konieczność zachowania kultury.
Bohatyrowiczowa 29 MAJA 2022 21:12
Schizofrenicy i inni chorzy psychicznie bywają czasami pełni wdzięku i polotu. Ty masz zaś obecnie fazę euforii, ale wiesz chyba, co po niej z reguły przychodzi, a więc lepiej nie odstawiaj lekarstw…
Dr Dein Freund
Marcin Nowak 30 MAJA 2022 7:27
Powiedz to @ppanek 29 MAJA 2022 14:30
On nazywa mnie sukinsynem, ale nie na odwagi nazwać mnie nim przed sądem. Czekam więc na jego dane personalne – ljkel2(at)netscape.net. Inaczej, to otrzymam je via prokuratura.
act 29 MAJA 2022 23:27
Propaganda alkoholizmu? 😉
A Dezerter wciaż czeka na wytyczne z Centrali. Biedaczysko…
widzisz kalvarya01, 7:34
dalem odpowiedz R. S. (troche krypto- i kroto-chwilnie) na jego zagadke. End of story.
A Twoj napuszony brak poczucia humoru i jakas zawzietosc, by odgrywac erudyte nie tylko mnie juz nudzi…gdybyz to od dzis.
Cytatami i plagiatami z Wiki nie zagluszysz pustki myslowej. Najlepiej wez nas wszystkich do sadu. Glownie za to, ze nie doceniamy kabotyna.
act 30 MAJA 2022 8:00
Znów tylko ad personam i przy tym wychodzi znów z ciebie zwykły Polish Cham, taki przez „ch” i raczej nie „polished”, tak jak to twoje swoiste poczucie humoru. 🙁
act 30 MAJA 2022 8:00
Poza tym, to NIE musisz czytać moich wpisów. One są zresztą dla osób inteligentnych a nie dla tępych wykształciuchów i pseudointeligentów z Koziej Wólki (przepraszam Kozy i Wólki), takich jak ty. :-(
act 30 MAJA 2022 8:00
I kup sobie wreszcie polską czcionkę. Choćby nawet używaną. ;-)
Coś da się obserwować, a czegoś musimy doczekać pod warunkiem że czasu nie zabraknie
PS. W radiu Wrocław o praworządności
ls42 30 MAJA 2022 8:35
Czas podobno można sobie kupić w kapitalizmie, tak jak wszytko inne, nawet miłość, rozum etc.
I co to jest ta praworządność i czym się ona różni od leworządności?
Zełenski dyscyplinuje Kijowian … z dziupli wysyła panikujące relacje w świat … a kiedy wyszedł zastał na ulicach rozweselone tłumy mieszkańców stolicy … Tak sobie myślę prywatnie … najciemniej pod latarnią … więzy życia w Kijowie górą …
Off topic:
Wiadomo, że Niemcy od czasów EWG, jak nie wcześniej,zyskiwali i dalej zyskują na członkostwie w UE, mając w ten sposób niegraniczony dostęp na rynki pozostałych państw-członków Unii, dostęp do ich surowców, siły roboczej etc. Poza tym, to Niemcy stały się ofiarą swojej własnej propagandy sukcesu – gdyby tak niemieccy politycy wpadli na pomysł, aby przy pomocy tzw. kreatywnej księgowości i tzw. financial engineering zmniejszyć ich PKB (GDP, d. Dochód Narodowy) to Niemcy dostawałyby, tak jak dziś np. Polska, dotacje z kasy unijnej. Ciekawe, dlaczego się o tym nigdzie nie pisze? Co to jest bowiem za problem zaliczyć część dochodów niemieckich firm i obywateli do formalnych transferów finansowych, niewpływających na wysokość owego PKB, szczególnie, że żaden laik czy nawet ekspert, ale bez dostępu do danych źródłowych, tego przecież nie zweryfikuje, a poza tym, to przecież to Niemcy mają decydujący głos w Komisji Europejskiej i w Eurobanku?
Kokosy zbijały niemieckie firmy na pośrednictwie w sprzedaży konsumentom rosyjskiego gazu … sami kupując w cenach łagodzących obyczaje z Rosją … Tak sobie myślę prywatnie … więcej rosyjskiego gazu rurą … ! to była pępowina życia … to więzy życia … a Morawiecki czepia się Norwegów …
Dlaczego banderowcy nie uznają Rosjan za rdzenną ludność … to więzy życia z terytorium … Tak sobie myślę prywatnie … banderowcy za podszeptem jankesów i Israela wolą do obcych strzelać jak do psów i kaczek … i co im zrobicie jak nie oddadzą płaszcza … to Putinowi jak gajowemu Marucha zostało …
@Marcin Nowak
kreacjonizm jest bardziej kwestią wiary niż nauki.
Toteż nie sądzę, żeby argumenty naukowe mogły przekonać kreacjonistów. Co najwyżej pojedyncze osoby.
Choćby nie wiadomo jak logiczne i naukowo uzasadnione argumenty przytaczać, to zawsze wrócą do swojej „pierwszej przyczyny”.
Oczywiście, nie oznacza to, że nie warto dyskutować.
Warto. Artykuły takie, jak Pański są bardzo cenne dla osób, które na co dzień nie zajmują się tą problematyką. A dzięki nim mogą zwrócić uwagę na coś na co dotychczas nie zwracali uwagi.
Jagoda 30 MAJA 2022 9:53
To jaka jest według kreacjonistów ta pierwsza przyczyna zaistnienia ich boga, bogów, bogiń etc.? A „nasz” Dezerter wciąż milczy…
@Jagoda:
Próbuję sobie przypomnieć źródło, bo na tygodniach wpadłem na relację byłego kreacjonisty, który mówił o zmianie swoich poglądów. Prosił by, przekonując i zwalczając poglądy kreacjonistyczne, nie uważać kreacjonistów za głupców. W jego przypadku może argumenty naukowe zadziałały, ale przede wszystkim zadziałała zmiana środowiska. Póki był wśród wychowanych i razem uczonych (rodzina, plus szkoła zdominowana przez środowisko ewangelikalne), był kreacjonistą. Zmienił poglądy wchodząc w środowisko bardziej świeckie i uprawiając naukę. To nie tyle był argument, co stopniowa zmiana podstaw wiedzy stosowanej do rozumienia świata.
PAK4 30 MAJA 2022 10:08
Kreacjoniści są głupcami z definicji, gdyż nie potrafią oni wyjaśnić, jaka jest według nich ta „pierwsza przyczyna” zaistnienia tych istniejących tylko w ich chorych umysłach boga, bogów, bogiń etc.
PAK4
30 MAJA 2022
10:08
Czyli nastąpiło osłabienie siły mechanizmu konformizmu.
Ciekawe byłoby sprawdzenie tego, w jaki sposób zachowałby się po powrocie do swojego pierwotnego środowiska. Na ile potrafiłby się oprzeć jego wpływom.
Z tego, co wiadomo na temat odporności na konformizm, ma spore szanse.
Jagoda – mylisz konformizm z praniem mózgów. :-(
PAK4
30 MAJA 2022
10:08
…Prosił by, przekonując i zwalczając poglądy kreacjonistyczne, nie uważać kreacjonistów za głupców…
Miał rację.
Ich poglądy są bardziej kwestią obrony spójności psychicznej, czyli psychicznego dobrostanu. A w niektórych przypadkach nawet zdrowia psychicznego, niż funkcjonowania sfery czysto kognitywnej, intelektualnej.
Obrażając nie tylko nie przekona się do swoich racji, ale wręcz wzmocni postawę obronną. Zerwie komunikację. Nasili wrogość.
Nie roszczę pretensji do udziału w dyskusji o entropii, ale po doniesieniach o sytuacji żołnierzy w szpitalach wojskowych sądzę, że dla wielu z nich więzy życia wiszą na włosku.
Ławrow przedstawił cele Rosjan na najbliższe dni.
Priorytetem jest zajęcie obwodów ługańskiego i donieckiego.
Prezydent Andrzej Duda rozpoczyna wizytę w Egipcie. Kiedyś prezes planował tam wakacje dla obywateli
„Ty masz zaś obecnie fazę euforii”
Że co?! Poważka?
Ja w Euforii, wczorajszego wieczora, i z Twojego powodu!?
W fazie na eufo byłabym dzieląc wyrko z Lagerthą Lothbrok,
a i gdyby tak do snu na moich udach ułożył sie Król Ragnar…
Mniam…
To Ja, My właściwie, z Schizą i Frenią złapiemy sie za dłonie,
i udamy się w poszukiwaniu ofiary, by złożyć Ją Thorowi,
by cię stąd definitywnie wystukał…!
(kulturalnie pomacham łapką, pa))
kalvarya01
Ludzie przyzwyczajają się do pewnych zasad postępowania. Praworządność moim zdaniem powinna te zasady określać w sposób prosty i nie budzący wątpliwości. W przypadkach naruszeń zapisanych reguł miałby zastosowanie kodeks karny.
To nie jest skomplikowany proces
@Jagoda:
Być może.
On to tłumaczył nieco inaczej — ja wiem, tu się różnimy raczej stawianiem akcentów, niż meritum — że wyniósł ze swojego środowiska pewien spójny obraz świata, a kolejne informacje dodawał do niego, gdy były spójne; lub odrzucał — gdy spójne nie były. Jaka to definicja prawdy w filozofii? Że budował swoje podejście na pewnej koherentności? Przejście w inne środowisko (uczelnia, kierunek uczenia się itp.) wystawiły go bardziej na argumenty naukowe, pozwoliły przemodelować te fundamenty wiedzy wyniesione z domu.
Przez te moje ostatnie lektury biblijne, czasami youtube mnie kwalifikuje jako fanatyka religijnego i podsyła a to polskich lefebrystów, a to jakieś Answer in Genesis. No i właśnie nieopatrznie kliknąłem (nieopatrznie, bo teraz YT zarzuca mnie propozycjami innych; a człowiek tylko chce się skupić na robocie ze Sztuką fugi w słuchawkach) na jeden ich filmik narażając się na więcej. A w filmiku pan prelegent mówił, że oczywiście, Arka Noego jest naukowo udowodniona, same zaś argumenty na istnienie światowego potopu zbył machnięciem rękami — jest ich tak dużo i są tak niepodważalne, że nawet nie chce mu się ich omawiać.
Uderzyło mnie, jak bardzo jest podobny do nas, tylko ma zupełnie inaczej ustawioną tą podstawę wiedzy. I jak tu dyskutować, skoro trzeba by rozebrać cały ten gmach spójnej wiedzy o świecie u niego, do ostatniej cegiełki?
Pierwsza Przyczyna, ‚First Mover’, ‚uncaused cause’ rodzi podobne paradoksy, jak postulat, ze ‚To Cos, co nazywamy Wszechswiatem’ istnieje wiecznie. Taki sam ‚infinite regress’ w mysleniu.
Bo jezeli ‚wiecznie’, to jak to jest mozliwe, ze Czas, i caly ten jazz z nim, dochodzi do jakiegokolwiek momentu majac cala wiecznosc przed ‚Teraz’?
Albo Czas ma kilka wymiarow, ktorych nigdy, istoty ‚linearne’ w mysleniu, jak my, nigdy nie pojmiemy, albo za sto, tysiac lat nastapi jakas rewolucja, nowy paradygmat w nauce. Nieskromnie nie sadze.
Od przeszlo stu lat nauka udaje (raczej slabo), ze cos rozumie z fizyki kwantowej i bredzi obiecujac (z tego zyje) Teorie Wszystkiego. Obiecuje Wielka Unifikacje.
Ale nie skarze sie, bo dzieki: temu ‚shut up and compute’ moge pisac na tym blogu nawet brednie.
Ten cytat z Hawkinga, ktory nie bardzo ‚tracil czas’ na filozofie, kazdy fizyk powinien miec na scianie:
„What is it that breathes fire into the equations and makes a universe for them to describe? The usual approach of science of constructing a mathematical model cannot answer the questions of why there should be a universe for the model to describe. Why does the universe go to all the bother of existing?”
Jagoda – ad konformizm i pranie mózgów. Obserwuję je na dyskusjach na temat obecnego konfliktu na Ukrainie. Otóż mnóstwo dyskutantów, mając mózgi wyprane przez reżimową propagandę i nie mając wyszkolenia wojskowego na poziomie „oficerskim”, nie potrafi zrozumieć, że tylko mocarstwo nuklearne pierwszej rangi, czyli w praktyce tylko USA albo Chiny (ChRL) są w stanie wygrać wojnę z Rosją i to też tylko za cenę ogromnych strat własnych, które muszą pociągnąć za sobą co najmniej upadek ich obecnych reżimów. To myślenie zwolenników Ukrainy nazywa się myśleniem życzeniowym i jest charakterystyczne dla osób religijnych.
act 30 MAJA 2022 10:56
Nie ma nic za darmo. Cena, jaką fizyka płaci za użycie zwięzłego języka matematyki i jej arbitralnie ustalonych metod, jest jej zdegenerowanie się i przejście na poziom pseudofilozoficznych, jałowych („sterylnych”) rozważań i „ucieczka” na manowce czysto matematycznych modeli typu superstrun, które są z definicji niemożliwe do naukowej, czyli empirycznej (praktycznej) weryfikacji. Użycie matematyki prowadzi też do manowców renormalizacji, pseudonaukowej hipotezy kosmicznej inflacji (Ockham z brzytwą się tu kłania), mocno zalatujących teologią „teorii” typu Big Bang etc. etc.
act 30 MAJA 2022 10:44
A tu zgoda – po prostu nie ma w tzw. realu czegoś takiego jak nieskończoność, wieczność etc., gdyż rodzi to z definicji nierozwiązywalne paradoksy i tym samym prowadzi, nawet w fizyce, np. do nienaukowych sztuczek typ renormalizacji czy też do tworzenia pseudonaukowych, nieweryfikowalnych hipotez typu superstrun. Stąd też jestem ekonomistą a nie fizykiem, bo w ekonomii, to praktyka i to na ogół dość szybko weryfikuje wszelakie teorie.
PAK4 30 MAJA 2022 =10:39
Po prostu nie rozumiesz różnicy między wiarą a wiedzą. Wiedza jest otwarta i zmienna ale nigdy nie jest kompletna i nigdy nie zna odpowiedzi na wszystkie możliwe pytania. Wiara jest zaś zawsze zamknięta, kompletna, niezmienna i dana „raz na zawsze” oraz zna ona odpowiedzi na wszystkie możliwe pytania, tyle że są to zawsze BŁĘDNE odpowiedzi.
ls42 30 MAJA 2022 10:39
Kto układa kodeks karny? Rządzący. Prawo jest bowiem skodyfikowaną wolą klasy rządzącej. Tylko tyle i aż tyle…
ls42 30 MAJA 2022 10:39
Prawo jest celowo bardzo skomplikowane i wewnętrznie sprzeczne, aby dać zatrudnienie prawnikom. Stąd też non omne quod licet honestum est.
Jagoda 30 MAJA 2022 10:23
Dyskusja z religiantami NIE ma sensu. Nauka jest bowiem otwarta i zmienna ale nigdy nie jest kompletna i nigdy nie zna odpowiedzi na wszystkie możliwe pytania. Wiara jest zaś zawsze zamknięta, kompletna, niezmienna i dana „raz na zawsze” oraz zna ona odpowiedzi na wszystkie możliwe pytania, tyle że są to zawsze BŁĘDNE odpowiedzi, gdyż wiara religijna jest rodzajem psychozy i to na masową skalę. Z wiarą religijną należy więc walczyć, a nie dyskutować, jeśli Ludzkość ma mieć jakąkolwiek przyszłość.
@kalvarya01:
Staram się być rozsądnym człowiekiem, przyjmować napływające argumenty, dyskutować je; orientować się w rzeczywistości, co oznacza znajomość podstawowych rzeczy związanych z nauką, historią, czy polityką. Ale: staram się, a nie jestem. Bo widzę w sobie ograniczenia poznawcze. I to dokładnie takie: jestem uprzedzony wobec faktów, dokładam do swojego rozumienia świata to, co mi pasuje do uprzedniej wiedzy.
Zastanawiam się, ile razy w życiu „przemodelowałem” moje widzenie świata. Jako nastolatek wierzyłem w potwora z Loch Ness, teraz już nie wierzę. Kiedyś uważałem, że Korwin mówi do rzeczy — całe pół godziny potrzebowałem by nabrać rozsądku i już nigdy więcej w to nie uwierzyć. Ba! Jako licealista byłem za zakazem aborcji, ale przeszło mi przed maturą. Popierałem też coś, co wygląda jak pojmowanie polityki karnej państwa przez PiS, no, ale byłem wtedy w młodszej podstawówce. Ja nawet kiedyś wierzyłem w hipotezę Chazarską (może „wierzyłem” to za dużo — „skłaniałem się ku”), oraz uznawałem, że RFN mieszało przy rozkładzie Jugosławii. Mam więc parę przypadków, gdy zmieniłem zdanie — uważam, że dałem się przekonać faktom, że lepiej zgłębiłem te tematy. Pewny nie jestem. Tak, czy inaczej, na cały mój życiorys to trochę mało, by być przekonanym, że kieruję się empirycznym poznaniem świata, a nie opiniami ludzi mi bliskich.
Po tym wyznaniu, pytam — ile razy w ciągu swojego życia odrzuciłeś przekonania, jako negatywnie zweryfikowane przez fakty? Czy więc, Twoje przekonania są wiarą, czy wiedzą, według Twojej własnej definicji?
kalvarya01,
swiat sie niemal zawalil Pitagorejczykom na glowe po odkryciu liczb niewymiernych, Bo wszystko miala byc Harmonia. No to tak, jak i np. Babilonczycy przed nimi, zaokraglali. 3.14 wystarczalo.
I to ‚shut up and compute’ dziala!!!
Czy po Cantorze, Goedlu etc swiat sie zawalil?, nie.
Wyswietlono niedawno ponad 50 trylionow cyfr w rozwinieciu liczby Pi, Pitagoras by zwariowal, a przeciez my, dzisiaj, z paradoksami Zenona z Elei nie radzimy sobie. Z kim do goscia?!
Powtorze, nie radzimy sobie z tym, co sami odkrylismy, to nieprawda, ze ‚wynalezlismy’ matematyke. Penrose i inni mowia (smiertelnie powaznie) o odzielnym ‚realm’ dla obiektow matematyki. Platon znowu, i jego nieslychane intuicje, wiecznie zywe.
Potrzebna nowa epistemologia i paradygmaty nauki ale to pobozne zyczenia, Bo wszystko jest Polityka, zapytaj Wieska 🙂
PAK4
To się nazywa „mądrość etapu”…..
Im cześciej natykasz się na dysonanse pomiędzy słowem a czynem, faktami a obowiązującym przekazem, tym cześciej musisz weryfikować pierwotne założenia, własną wiedzę.
Pod warunkiem oczywiście, że masz otwarty umysł, a nie trzymasz go w klatce z dogmatami.
Dlatego też starsi ludzie byli autorytetami dla młodych.
Dysponując doświadczeniem życiowym bezbłędnie wyławiali fałsz.
Taki mechanizm zniknął w społeczeństwach bogatych.
Nie ma kto weryfikować, czy prostować obrazu swiata.
Media to bardzo krzywe lustro.
Nikt nie wie, jaki był poczatek życia.
Kwestia końca też niekoniecznie jest zgłębiona.
Zużycie telomerów nie jest pełną odpowiedzią.
PAK4 30 MAJA 2022 11:55
Ale ja nigdy w nic nie wierzyłem a tylko przyjmowałem, to co mi mówiono w domu czy szkole, z rezerwacją i konfrontowałem to z rzeczywistością, także przy użyciu przyrządów etc. Nie musiałem więc, jako niewierzący, odrzucać przekonań, gdyż moje przekonania oparte były i są na wiedzy, a nie na wierze. Oczywiście, dawniej uważałem np. że proton jest cząstką elementarną, a teraz wiem, że nią nie jest, ale takie było przecież dawniej stanowisko fachowców, czyli tu fizyków jądrowych. W tym sensie to ja ciągle zmieniam swoje przekonania, a raczej aktualizuję swoją wiedzę, ale nie wierzenia, bo ich po prostu nie mam.
Natomiast teoria Chazarska i to, że RFN mieszało przy rozkładzie Jugosławii, to wszystko jest oparte na faktach.
wiesiek59 30 MAJA 2022 12:12
Starsi ludzie to byli autorytetami dla młodych, kiedy wiedza stała praktycznie w miejscu. A dziś jest inaczej niż było…
act
30 MAJA 2022
11:58
Nie wchodzę w temat wyższej matematyki.
Kompletnie mi nie pasuje.
Natomiast przyswoiłem sobie kilka historycznych faktów z jej rozwoju.
I to mi wystarczy.
act 30 MAJA 2022 11:58
Ilu było Pitagorejczyków? To była garstka wykształciuchów bez praktycznego znaczenia w epoce niewolnictwa i taniej siły roboczej. Zresztą oni nie tyle wiedzieli, co wierzyli. Poza tym, to matematyka istnieje tylko umysłach matematyków i jest ich też wiele – tyle ilu jest wybitnych matematyków, tak jak w filozofii czy teologii. Ale zgoda co do negatywnej roli polityki w nauce. „Dzięki” polityce, to niedługo nie będzie już nauki na tzw. Zachodzie, gdyż zniszczy ją polityczna poprawność.
wiesiek59 30 MAJA 2022 12:18
A może jej posmakujesz? ;-)
@kalvarya01:
> . Nie musiałem więc, jako niewierzący, odrzucać przekonań, gdyż moje przekonania oparte były i są na wiedzy, a nie na wierze.
W zasadzie takiej odpowiedzi się spodziewałem.
PS.
Tak sobie myślę prywatnie, że postrzegamy samych siebie głównie fałszywie; że często wręcz przeciwieństwo tego, co o sobie myślimy jest prawdą. Trochę jak z partiami politycznymi — każda ma w nazwie to czego jej brakuje: sprawiedliwość, obywatelskość, sojusz, ludowość, republikę, czy demokrację itp.
Oczywiście, czasem stosuję tę myśl do siebie i własnych wyobrażeń o sobie. I się przerażam.
Po wycięciu kilku dni z bloga , co robi jego entropia ?
Co by nie robiła powinno się ją traktować odpowiednio
https://www.youtube.com/watch?v=i5fUw1ZQz3c
PAK4 30 MAJA 2022 13:02
Trzeba to było napisać ex ante, a nie ex post. ;-)
Poza tym, to na jakiej podstawie uważasz, że moje przekonania oparte były i są na wierze, a nie na wiedzy? Bo uważasz, że jak ci to xiądz na katechezie wbił do głowy, że „każdy człowiek musi w coś wierzyć”?
olborski 30 MAJA 2022 13:20
Ona się wciaż zwiększa.
Po raz pierwszy w historii walczy czterdzieści państw, w tym trzy mocarstwa, przeciwko jednemu.
Wprawdzie to jedno poszło na zwarcie, ale z pewnością takiego ciągu wydarzeń się nie spodziewano.
Do tego działania bojowe toczą się dotychczas tylko na części terytorium jednego z państw, a obawa dotyczy tego czy konflikt nie nabierze mocy i się nie rozprzestrzeni na inne.
Można przewidywać, że ktoś policzy zyski i straty i powie dosyć walki, ale to pewne nie jest. Aby jedni czy drudzy spełnili zapowiedzi trzeba czasu, a czasu nie ma, im dalej w las tym więcej drzew. Będąc na skraju tych zmagań i widząc co się dzieje nie mam złudzeń. Walka na wyniszczenie nie ma sensu. Ile lat będzie trzeba na pogodzenie towarzystwa, a jeszcze więcej na odbudowę ludzkich siedzisk i zniszczonej infrastruktury. Jak żyć w takiej sytuacji mając miecz nad głową?
PAK4 30 MAJA 2022 13:02
A w co Ty wierzysz? W Latający Potwór Spaghetti (Flying Spaghetti Monster), w Tróycę Świętą, w Matkę Boską, Niepokalane Poczęcie, Jehowę (JHWH), Szechinę, czy może w Ahurę Mazdę (nie mylić z Mazdą 626)?
@mfizyk
29 MAJA 2022
21:15
🙂
najwazniesza jest elegancja i takiej dostarcza czesto matematyka.
Ale im wiecej zagmatwan i ‚mambo jumbo’ tym mniej wiarygodny opis zjawiska fizycznego.
A propos: podobal mi sie przyklad lalecznika.
Jestem na etapie programowania mojego robota domowo-ogrodowego.
Walcze z forward and inverse kinematics aby dostosowac robota do platformy linuxcnc. Duzo problemow, rowniez na etapie niewydolnosci hardwaru.
To dobra gimnastyka umyslowa.
Mysle, ze robotyke nalezaloby wprowadzac juz na etapie szkoly podstawowej.
Całkiem trafne jest tutaj słowo „radykalny” – radykalny wywodzący się z łaciny i oznaczający „korzeń”. Radykałowie nie zadowalają się kosmetycznymi zmianami i dążą do wyrwania korzeni starego porządku i zastąpienia go innym.
Ale większość z tych malkontentów wydaje się niezdolna do zmiany rzeczywistego podejścia, jakie mają do religii. Być może byliby w stanie wymienić Jezusa na Thora lub Odyna, ale nie zmienili niczego innego. Krótko mówiąc, po prostu szukają nowych/starych obiektów do oddawania czci, a ich podstawowym punktem spornym z innymi systemami religijnymi jest to, kogo lub co czcić, a nie sama praktyka kultu.
To wszystko nasuwa pytanie: jaki jest sens kultu? Oraz: Czy w ogóle tego potrzebujemy?
https://roloslavskiy.substack.com/p/reactionary-metaphysics-ii-problems?s=r/
ls42 30 MAJA 2022 13:35
Jak widać, zniszczenie Ukrainy jest obecnie w interesie nie tylko Rosji, ale także USA i Chin. A większość świata jest dziś za Rosją, by the way. Poza tym, to UK i Francja od dawna NIE są mocarstwami.
wiesiek59 30 MAJA 2022 13:43
Kult NIE ma sensu ale potrzebują go rządzący nami.
R.S. 30 MAJA 2022 13:43
Elegancja jest tylko dla mieszczaństwa czyli burżuazji i klas od niej wyższych, a matematyce to daleko jest zresztą do elegancji, np. z tymi liczbami niewymiernymi, z jej paradoksami nieskończoności, z jej niezdolnością do rozwiązania większości równań różniczkowych etc. etc…
@mfizyk:
Kalvarya tu odsłonił imię i nazwisko linkując swój tekst o reformie nauki. Może wypadło w weekendowych czystkach…? W każdym razie, tak, ma na swoim koncie książkę o Lemie.
PAK4 30 MAJA 2022 14:10
Ano ma i to nie jedną. 😉
Reformę nauki postanowiono przeprowadzić w Rosji.
Odejść od systemu bolońskiego, jako obniżającego poziom wiedzy.
Czyli, zlikwidowane będą Wyższe Szkoły Gotowania na Gazie….
Ma to sens.
Liczy się STEM, nie pierdoły.
Powrócę, na chwilkę do przytoczonego wcześniej zadania, zagadki.
Otóż, aby ja rozwiązać, wystarczy mieć trochę wyobraźni na przykład ogrodnika. Nie trzeba uciekać do tajemniczych słów i nazw funkcji lub równań i starać się zamanifestować swą mądrość.
Ogrodnik przycina tyczki o odpowiednich długościach.
Czyli 28cm 55cm 21 cm, po czym ustawia je w punktach x=5, y=3; następnie x=7 y=6 i na koniec x=4 y=5. Kładzie na tyczkach plaski daszek i na koniec w punktach x=3 i y=8 podpiera tenże czwartą tyczką.
Metoda i podejście do rozwiązania problemu jest jak najbardziej elegancka. Bez uciekania się do mambo jumbo.
W podobny sposób stosując modele w wyobraźni lub eksperymenty modelowe niektórzy wielcy naukowcy dochodzą do wspaniałych odkryć. Ich sukcesy są w jakiś sposób uwarunkowane.
Jeśli nie ma takiego uwarunkowania pozostaje teorie promowane przez kreacjonistów.
Inne osbniki o rozwiniętym nadmiernie ego uciekają się do powielania i kopiowania lub omawiania co autor miał na myśli. Ilość napisanych esejów, oczytania, kopiowania i ględzenia na temat własnej inteligencji jest zdecydowanie mniej elegancka od metody, która zastosował ogrodnik.
I to by było na tyle w temacie.
R.S. 30 MAJA 2022 15:26
Ogrodnik nie posługuje się w swej pracy symbolami i typu x, y czy z. A ta cała durna zagadka, oparta na błędnej interpretacji znaku równości, przypomina mi zaś to: „Jest dom o trzech piętrach, każde piętro ma osiem okien. Na dachu są dwa dymniki i dwa kominy. Na każdym piętrze mieszkają dwaj lokatorzy. A teraz powiedzcie, którego roku umarła babka stróża?” (Zagadka Szwejka).
Rozwiąż ją, mądralo. Odpowiedzi nie znajdziesz w Sieci. Musisz spróbować użyć to tego resztek swego zdegenerowanego mózgu.
wiesiek59 30 MAJA 2022 15:22
Gotowanie na gazie jest sztuką, a ci, którzy ja w pełni opanowali, są szefami kuchni w ekskluzywnych restauracjach i zarabiają więcej niż ministrowie czy nawet premierzy i prezydenci.
O ile mogę zrozumieć podróż prezydenta do Egiptu, to już podróż ministra po kolejne nowe czołgi jest dla mnie zagadkowa.
Mamy już czołgi radzieckie, niemieckie, amerykańskie i pewnie jeszcze inne z zachodu, to czy potrzebne nam są jeszcze czołgi z dalekiego wschodu?
Co jest w nich ciekawego, czego nie ma w tych co są?
Ponadto mieliśmy różnego rodzaju broń od różnych dostawców. Do każdego rodzaju broni potrzebne są części zamienne i amunicja. Jedno i drugie jest niezbędne, ale przy takim doborze można się pomylić.
W mediach staje mówi się o tym, że broń to nie wszystko, bowiem potrzebni są wyszkoleni żołnierze, co te nowoczesne zabawki potrafią obsługiwać. Bez szkolenia się nie obędzie, a to wymaga czasu. I tak znowu wraca problem czasu, którego nie ma.
Mogę się zgodzić z uwagą, że czas można kupić, ale znowu jest kłopot aby znaleźć pieniądze na ten cel, a tych jak wiemy akurat nam brakuje.
Jednym słowem ofensywa dyplomatyczna może się załamać i to na naszych oczach, bo przecież nasza uwaga skupiona jest na doniesieniach medialnych i nic przed dziennikarzami nie da się ukryć.
Wiemy też, że nie tylko broń i amunicja są potrzebne. Potrzebne są też schrony, a tych nie ma w odpowiedniej ilości. Jak już pisałem brakuje nam schronienia dla 96% populacji na wypadek ataku.
To może lepiej zamiast kupować czołgi zajmijmy się budową schronów
R.S. 30 MAJA 2022 15:26
Inna zagadka dla Ciebie: Jak ma na imię pani Kasia?
ls42 30 MAJA 2022 16:02
To nie nam są te czołgi potrzebne, ale politykom nami rządzącym, potrzebne są łapówki od producentów tychże czołgów. Ty chyba jesteś z Wenus? 😉
R.S. 30 MAJA 2022 15:26
Także: Na przyjęciu imieninowym gospodarz opowiada: pamiętam swoje imieniny sprzed wielu lat, wyszedłem o świcie z namiotu, przeszedłem 200m na południe, potem 200m na wschód, a potem 200m na północ, i w efekcie wróciłem do namiotu. Jak miał na imię gospodarz przyjęcia?
ls42 30 MAJA 2022 16:02
Byleś kiedyś w Albanii? Oni tam wydali prawie cały swój PKB na budowę schronów. Pierwsze stacje metra w Warszawie też są schronami. Siedź więc w nich, jeśli masz taką ochotę ;-)
@ PAK4
30 MAJA 2022
14:10
Ciekawe po co zmienia niki, jezeli i tak nie potrafi sie „zadekowac” 😉
R.S. 30 MAJA 2022 15:26
Nie będę okrutny, a więc Ci podpowiem, że babka stróża jest wiecznie żywa, tak jak Maryja Zawsze Dziewica (Semper Virgo) i tow. Lenin.
mfizyk 30 MAJA 2022 16:17
Zmuszają go do tego okoliczności od niego niezależne, ale on przecież nigdy nie ukrywał swej tożsamości z realu, w odróżnieniu od Cię. Może dlatego, że nie ma on się czego wstydzić, w odróżnieniu od Cię? ;-)
I ty też byłeś kiedyś „małym fizykiem”… Jak to mówią, przyganiał kocioł garnkowi! :-)
@ PAK4
@ Jagoda
„I jak tu dyskutować, skoro trzeba by rozebrać cały ten gmach spójnej wiedzy o świecie u niego, do ostatniej cegiełki?”
Juz starzy Grecy wiedzieli, ze nikogo nie mozna niczego nauczyc. Bo kazdy musi sie sam nauczyc.
Ale, zeby sie czegos (abstrakcyjnego) nauczyc, potrzebne sa zdolnosci intelektualne (analityczne). To jednak nie wystarcza. Bo wedlug mnie niechec do nauki bazuje na (co najmniej) trzech zachowaniach:
– inercji
– homeostazie
– i juz wspomnianym komformizmie.
Moze chodzi o ewolucyjne uwarunkowanie, aby zminimalizowac zurzycie energii. Bo nasz mozg zurzywa ok. 50% (a moze i wiecej) naszej dziennej energii. Tyle, ze aktywna obrona przed nauka (jak np. u kreacjonistow) zurzywa co najmniej tyle samo energii co skuteczna nauka 😉
@kalvarya01
Jednym z przejawów inteligencji jest zdolność do oceny poziomu intelektualnego rozmówcy, której to zdolności jesteś całkowicie pozbawiony.
mfizyk 30 MAJA 2022 16:40
Niechęć do nauki (tu rozumianej jako rzeczownik) bazuje na Nieświętej Tróycy: lenistwie, braku inteligencji i przejściu prania mózgu w dzieciństwie.
Redes22 30 MAJA 2022 16:49
Niestety, ale poza mną, to nie widzę tu nikogo inteligentnego, a tylko samych wykształciuchów i ćwierćinteligentów, a więc zmuszony jestem aby dyskutować tu samemu z sobą, używając inne nicki w charakterze tzw. słupów. ;-)
@mfizyk:
Taki filmik widziałem na YT*, gdzie tłumaczyli, że zwolennicy teorii spiskowych nie różnią się od „normalsów”, gdy czytają dane wiarygodne; ale różnią się, gdy dostają „dane niskiej jakości” — jakby nie potrafili ich zweryfikować, odnieść się, poddać krytyce.
Jakoś tak mi się przypomniało a propos niektórych głosów…
—
*) Zarówno prawda, jak i świadoma parodia 😉
PAK4 30 MAJA 2022 16:56
Rewolucja Październikowa była spiskiem Bolszewików, Rewolucja Amerykańska była spiskiem bogatych burżujów z Nowej Anglii, powstanie PRL-u było spiskiem kierowanym przez Stalina a skierowanym przeciwko Zachodowi, zamachy na Kennedych, Palme’go, Kinga (Martina Luthera) etc. były klasycznymi wręcz spiskami. Stąd też rządy i tzw. establishment wyśmiewają tych, którzy widzą spiski, gdyż oni, czyli rządzący, na ogół dochodzą do władzy drogą spisku, np. Solidaruchy, które spiskowały z Post-komuchami przeciwko uczciwym, pracującym Polakom podczas obrad tzw. Okrągłego Stołu i tą metodą doszły do władzy w Polsce.
PAK4 30 MAJA 2022 16:56
Gdzie masz dziś te wiarygodne informacje?
kalvarya01
30 MAJA 2022
7:14
Dziekune za korekte gramatyki. Nie jestem Zydem i nie rozumiem uzycia slowa „szalom” w konteksie mijego wpisu.
Dla rozjasnienia umyslu ten link
https://consciousness.arizona.edu/
Marcin Nowak
30 MAJA 2022
7:25
https://consciousness.arizona.edu/
Schizophrenia
Ktos poruszyl ten temat. Schizofrenia jest choroba swiadomosci. Osoba w narkozie gazowej nie produkuje halucynacji. Schizophrenia ma materialne wutlumaczenie bo gaz anestetyczny jest materialny. Schizophrenia jest choroba microtubules.
@mfizyk
Jedną z przyczyn, dla których obecny kalvarya01 zmienia nicki, jest ciągłe banowanie. Ten blog rzadko banuje, więc tu najwięcej ma szansy na swoje wynurzenia, ale bodaj z raz był też tu zbanowany pod nickiem nawiązującym do Chazarów. A i może niedługo trzeba będzie to powtórzyć.
Slawomirski 30 MAJA 2022 17:51
Nikt tak naprawdę nie wie, co to jest schizofrenia, co ją powoduje a szczególnie jak ją leczyć.
Blog szalonych naukowców 30 MAJA 2022 18:23
Prawda w oczy kole, władza demoralizuje, zaś władza absolutna demoralizuje absolutnie (Lord Acton). I co wam przyjdzie ze „zbanowania” mnie? Sadystyczna przyjemność pokazania, że ma się władzę? To już przerabialiśmy za Sanacji, Okupacji i PRL-u, ale na szczęście nie macie przecież władzy nad Internetem.
Blog szalonych naukowców 30 MAJA 2022 18:23
Zapewne jesteście szaleni, tak jak ja i większość ludzi na tzw. Zachodzie i jego okolicach, ale na pewno nie jesteście naukowcami, a najwyżej pracujecie na etatach należących do instytucji mających naukę czy edukację w swej nazwie, ale z prawdziwą nauką niewiele mających wspólnego. Poza tym, to istnieje życie poza waszym blogiem, a więc znajcie proporcjum, mocium panowie. ;-)
kalvarya01
30 MAJA 2022
18:27
Slawomirski 30 MAJA 2022 17:51
Nikt tak naprawdę nie wie, co to jest schizofrenia
Ja wiem to choroba microtubules.
Slawomirski 30 MAJA 2022 18:43
Bo Ty wiesz wszystko, jak tow. Stalin.
Mam nadzieję, że mnie tu wkrótce zbanują, bo znudziło mi się pisać pod tym nickiem.
Filmik, który widziałem — żeby nie być gołosłownym:
https://www.youtube.com/watch?v=DHiv8aQYlBA
I na koniec – Lord Acton w całości: „Power tends to corrupt, and absolute power corrupts absolutely. Men in power are almost always bad men”. A teraz banujcie mnie dla waszej chorej satysfakcji, szaleni panowie pseudonaukowcy. Żegnajcie, ale pamiętajcie – I’ll be back.
„Jeżeli prawdę powiada aforyzm, że
„piękne jest zimne”, to mamy także prawo określić
piękne jako przybrudzone.
W każdym razie nie da się zaprzeczyć, że wśród
elementów składających sie na to, co nazywamy
„wytworną elegancją” i co daje nam tyle radości,
jest miejsce także na szczyptę nieczystego,
czegoś, co jest na bakier z higieną.”
źródło: Jun’ichiro Tanizaki – Pochwała cienia
I to tyle w temacie napuszonych gości bloga!
Raz, dwa, trzy – zaklepuję!!!
@kalvarya01 już się z nami nie bawi!
Wybebeszę szafkę z garami, powytłukuję wspomnień czar:
https://www.youtube.com/watch?v=r_0sL_SQYvw
mfizyk
30 MAJA 2022
16:40
Juz starzy Grecy wiedzieli, ze nikogo nie mozna niczego nauczyc. Bo kazdy musi sie sam nauczyc.
Psycholog amerykański J. Bruner wyróżnił w roku 1986 („Actual minds possible, worlds”)dwa tryby poznania.
Tryb paradygmatyczny, dominujący w przekazywaniu wiedzy szkolnej, akademickiej. I tryb narracyjny dominujący w poznaniu społecznym. Najskuteczniejsze jest takie uczenie, które pozwala na jak najszersze wykorzystywanie trybu narracyjnego. Również w przekazywaniu wiedzy szkolnej, akademickiej.
Przypuszczam, że Grecy mieli świadomość tego.
Chodzi o to, że wiedza, której nie wpleciemy we własną narrację o sobie, życiu, świecie bardzo trudno przechować w pamięci długotrwałej.
Na studiach mawiało się o trzech „z”. Zakuć, zdać, zapomnieć.
„Każdy musi się sam nauczyć” oznacza, w rozumieniu Brunera, wplecenie wiedzy w osobisty kontekst poznającego.
Może zainteresuje Cię ten artykuł:
https://depot.ceon.pl/bitstream/handle/123456789/964/Narracyjne%20rozumienie%20innego%20cz%C5%82owieka%20a%20jako%C5%9B%C4%87%20wi%C4%99zi%20spo%C5%82ecznych.pdf?sequence=1
Emocje
Czy emocje istnieja u pantofelka. Chyba nie bo emocje sa produktem synaptycznych polaczen. Niemniej pantofelek radzi sobie z zyciowymi problemami. Nie radza sobie osoby tu piszace. Wala w klawiature a nie maja nic do powiedzenia.
PAK4
30 MAJA 2022
10:39
On to tłumaczył nieco inaczej …
I jak tu dyskutować, skoro trzeba by rozebrać cały ten gmach spójnej wiedzy o świecie u niego, do ostatniej cegiełki?
Jeżeli dobrze Cię zrozumiałam to dokładnie chodzi o konformizm i zachowanie spójności psychicznej.
W odpowiednich warunkach możliwa jest restrukturyzacja wiedzy czyli przebudowa „gmachu”.
Nie dokona się tego atakując, okazując pogardę.
Mówi o tym „paradoksalna teoria zmiany” Perlsa.
Dzisiejsze występy polskich tenisistów w czwartej rundzie Wielkiego Szlema w Paryżu pogorszyły moje samopoczucie w większym stopniu niż sytuacja na świecie, a wiemy, że nie jest dobrze.
Hubert Hurkacz przegrał dwa pierwsze sety, wygrał trzeci, a w czwartym po przełamaniu Norwega, miał prostą drogę do piątego seta i ewentualnej wygranej.
Niestety w czwartym gemie uderzał tak fatalnie, że stracił gema i przegrał seta, a po tym blamażu nie mógł się już odnaleźć. Piąty set dla naszego zawodnika powinien być obowiązkowy.
Po południu na kort wyszła Iga Świątek. Nie grała źle, ale robienie min po nieudanych zagrywkach nie przystoi zawodniczce znajdującej się na czele rankingu WTA. Przegrala seta mając gem serwisowy na wygranie i cztery piłki setowe.
W tie-breaku prowadziła 5:2 i nie wykorzystała szansy. Tymczasem Chinka grała bardzo dobrze i zanosiło się na sensacyjną porażkę Polki.
W nerwach poszedłem na długi spacer. Po powrocie żona powiedziała „i po co nerwy Iga wygrała mecz”.
Dochodzę do siebie obserwując mecz Rosjanina z Chorwatem
Każdy student, który powiedziałby na egzaminie, że schizofrenia to choroba świadomości, oblał by.
M Nowak
30 MAJA 2022
22:14
Bez konca mozna mowic o halucynacjach, urojeniach i demencji ku uciesze i udreczeniu egzaminatorow. Moim zdaniem schizofrenia jest choroba microtubules (MT) tak samo jak demencja. A ze MT tworza swiadomosc to mozna powiedziec ze schizofrenia to choroba swiadomosci.
@ Jagoda
30 MAJA 2022
20:42
„Najskuteczniejsze jest takie uczenie, które pozwala na jak najszersze wykorzystywanie trybu narracyjnego. Również w przekazywaniu wiedzy szkolnej, akademickiej.”
Nauki spoleczne to nie moja specjalnosc. Spojzalem do podanego artykulu i raczej watpie, zeby mozna bylo przekazywac bardzo abstrakcyjna (czyli nie zwiazana z codziennymi doswiadczeniami) wiedze z fizyki czy matematyki (ogolnie nauk scislych) przy pomocy tej metody (trybu narracyjnego).
PS. Cos zrozumiec, to dla mnie cos wiecej niz „zakuc”. Jezeli ja cos „zrozumie”, to moge to tworczo rozwijac a nie tylko powielac.
” W przedchorobowej linii życia chorych na schizofrenię często obserwuje się
niedostatek zabawy w ich stosunkach z otoczeniem.
Niekiedy wpływa na to zbyt opiekuńcza postawa rodziców, którzy nie
pozwalają dziecku bawić się z rówieśnikami; nieraz dziecko „z natury”
jest nieśmiałe, unika kontaktów zabawowych, czasem jakiś uraz zraża
je do stykania się z rówieśnikami.
W socjoterapii schizofrenii ważną rolę odgrywa postawienie właściwego
akcentu na element zabawowy.
Niekiedy po raz pierwszy w życiu chory dopiero w szpitalu uczy sie
bawić, traktować życie mniej serio, zawiązuje pierwsze flirty,
uczy się tańczyć itp.”
„Primum philosophari, deinde vivere.”
źródło: Schizofrenia – Antoni Kępiński
Dziewcząt tudzież darowanych Schizy i Frenii, nie zwracam…
Pobyłam…Miejcie się wszyscy w zdrowiu!
@ PAK4
30 MAJA 2022
18:56
Troche przydlugi ten wyklad.
A i tak nie dowiedzialem sie co to „dane/dowody wysokiej jakosci” (min. ca 50) 🙁
Wykresy z dopamina tez mnie nie przekonuja. Bo rozrzut pomiarow jest tak duzy (jak mi sie wydaje), ze kazda z tych 3 srednich swobodnie miesci sie w przedziale zaufania kazdej innej sredniej.
@act
Why does the universe go to all the bother of existing?
To pytanie, jak wszyscy wiedzą, postawił wcześniej Leibniz. Czy może ktoś jeszcze przed nim? Musi ono pojawiać się w wielu jaźniach, bo pamiętam, że zaprzątało moją w wieku wczesno szkolnym. Szczególnie w czasie mszy, która zmuszała do bezczynności. Myślałam sobie, że nie istnienie niczego byłoby zrozumiałe w przeciwieństwie do istnienia świata. I to nic wyobrażałam sobie jak skupiającą się ciemność, czyli w końcu jako coś.
Może warto by rozważyć entropię wojenną, wojennego zabijania i zniszczeń wojennych.
@ls42 30 maja 2022 13:35
Po raz pierwszy w historii walczy czterdzieści państw, w tym trzy mocarstwa, przeciwko jednemu. […]
Można przewidywać, że ktoś policzy zyski i straty i powie dosyć walki, ale to pewne nie jest.
W II WŚ walczyło chyba jednak więcej. Pokusiłem się zrobić bilans ukraiński ale że długi, nie będę nim tu zaśmiecał.
Wracając do kwestii wojennej entropii i nawiązując do uprzedniej dyskusji o heliocentryźmie islamskich astronomów – w 1258 r. armia Mongołów pod wodzą Hulagu, wnuka Dżingiz Chana, zdobyła po krótkim oblężeniu Bagdad. Mongołowie wymordowali większość mieszkańców, złupili co się dało i obrócili miasto w gruzy. Wszystkie znalezione księgi palili, lub wrzucali do Tygrysu, tak że, jak utrzymuje tradycja, woda w rzece stała się czarna od atramentu. Nikt nie jest w stanie powiedzieć, jakie skarby wiedzy i nauki przepadły bezpowrotnie w tej orgii niszczenia, biorąc pod uwagę że w mieście gromadzono przez 500 lat owoce dorobku intelektualnego i naukowego. W Bagdadzie był „Dom Mądrości” (instytut naukowy założony przez kalifa Al-Mamuna, z ogromną biblioteką), 36 bibliotek publicznych, dwie Madrasy, które zostały w XI i XIII w. przekształcone w uniwersytety powszechne – Nizamiję i Mustansiriję i ok. 100 księgarni. Wielu zainteresowanych wiedzą dworzan i bogatych kupców gromadziło własne obszerne księgozbiory. Na Zachodzie biada się nad niecałkiem prawdziwym losem Biblioteki Aleksandryjskiej, podczas gdy prawdziwa katastrofa dla wiedzy – w Bagdadzie jest pomijana i zapomniana.
PS. Mongołowie byli wówczas jeszcze animistami, nie muzułmanami, tak że nie da się ubrać w to islamu.
Całość tu:
https://kobieta.gazeta.pl/kobieta/7,107881,28458270,sara-i-edwin-odeszli-od-swiadkow-jehowy-ktos-mi-bliski-stal.html#s=BoxWWImg4Mauro Rossi 30 MAJA 2022 21:32
Rosjanie rozpoczęli stawianie płota granicznego … Tak sobie myślę prywatnie … nawet w burdelu musi być porządek … ! mawiał mój szefa … w Donbasie i okolicy będzie miedza na trzy palce … taka sprawiedliwość z pomocą granata …
mfizyk
30 MAJA 2022
23:27
…watpie, zeby mozna bylo przekazywac bardzo abstrakcyjna (czyli nie zwiazana z codziennymi doswiadczeniami) wiedze z fizyki czy matematyki (ogolnie nauk scislych) przy pomocy tej metody (trybu narracyjnego)….
Czy chcesz powiedzieć, że nasze codzienne życie nie podlega prawom fizyki i innych nauk ścisłych?
Chyba nie.
Dobry nauczyciel potrafi to pokazać.
Znam taką nauczycielkę fizyki.
Tu przykład wykorzystania trybu narracyjnego:
https://www.youtube.com/watch?v=HHN5Y0sVq7A
Kijów znów tętni życiem … mieszkańcy tłumnie wyszli na ulice … olewają rzekomą wojnę totalną o wolność świata … Tak sobie myślę prywatnie … Putin strachy na Lachy … ? więzy życia mają swoje prawa …
Czy banderowcy są misjonarzami zachodniej cywilizacji … IPN tego nie potwierdza … Tak sobie myślę prywatnie … to fałszywe proroctwo … ludobójstwo Polaków na Wołyniu nie spadło z nieba …
Ludzie różnią się kolorem skóry i skłonnościami.
Po ostatniej strzelaninie w USA w telewizji zastanawiano się jak zapobiegać podobnym przypadkom. Statystycznie najwięcej zdarzeń związanych z użyciem broni palnej w USA zdarzyło się dotąd w miejscach pracy, sklepach, restauracjach. Szkoły dopiero na siódmym miejscu w tej statystyce.
Każdy stan w USA inaczej reguluje dostęp do broni i sposoby jej zabezpieczenia. Są wymogi przechowywania broni w specjalnych pomieszczeniach, zabezpieczenia przed dziećmi, ale nie wszędzie.
Amerykanie chcą mieć broń i nie chcą się jej pozbyć. Powstają zatem programy ochrony szkół przed atakami desperatów, ale to nie pomaga. Pancerne szyby nie ochronią dzieci jak napastnik jest w środku. W każdym razie to jest tam duży problem i czas aby tym się zająć.
Tymczasem to my zajmijmy się przygotowaniem zapasów na zimę, abyśmy nie zostali zaskoczeni.
Jakie produkty można kupić przydatne na czarną godzinę, które przechowywane w domowych warunkach nie ulegną zepsuciu. Podstawowy to alkohol, temu zimno nie zaszkodzi, a nawet czystej wódce pomoże. Dżemy też mają długi termin do spożycia. Wędliny długo dojrzewające, mrożonki (pod warunkiem, że nie wyłączą prądu).
Mam nadzieję, że tych propozycji będzie więcej w miarę upływu czasu.
Miłego dnia wszystkim życzę i przypominam o możliwości dalszego kibicowania tenisistom w Paryżu
Kiedy Biden uwłaszczy Rosję Donbasem i okolicą na podobieństwo Wzgórz Golan przez Trumpa na rzecz Israela … Tak sobie myślę prywatnie … tzw. zachodnia cywilizacja pokazuje innym mapy drogowe … czyńcie ziemię poddaną …
@ Jagoda
31 MAJA 2022
9:03
Nie do konca rozumie co to jest „tryb narracyjny”.
W pierwszym linku chodzilo chyba o wskrzeszanie empatii dla zrozumienia innego czlowieka:
„Celem artykułu jest prezentacja szeregu badań nad narracyjnym rozumieniem drugiego człowieka…
W szeregu eksperymentów stwierdzono, że narracyjny sposób rozumienia innej osoby pozytywnie wpływa na zaangażowanie w jej sprawy i na pomoc, gdy jest
w potrzebie. ”
W drugim linku widze tylko slowny opis eksperymentu. A to wedlug mnie nie jest „zrozumieniem”. Ten prosty opis raczej nie pomoze w zrozumieniu, skad sie bierze wykres fazowy (pokazany na poczatku) i dlaczego on jest inny dla roznych substancji. Bo do tego jest potrzebna abstrakcyjna wiedza o molekulach i ich wlasciwosciach. A tego znowu nie mozna zrozumiec bez juz kompletnie abstrakcyjnej (i niewyobrazalnej) fizyce kwantowej.
Ale w medycynie nie ma najmniejszego znaczenia czyjeś zdanie.
https://thesaker.is/top-guns-kishida-and-us-biden-showdown-with-russia-and-china/
==========
Trochę o degrengoladzie Japonii….
Ale podoba mi sie komentarz:
ABC 30 maja 2022 r. o 9:23 czasu EST/EDT
Jako Chińczyk lubię oglądać zachodnie komentarze o Chińczykach, którzy nie są wojowniczy i nie są w stanie dobrze walczyć. Po prostu mylą pacyfizm ze słabością. Chińczycy mają długą historię tradycji wojennych, ale będąc państwem cywilizacyjnym od wieków, rozumieją, że przemoc jest tylko tymczasowym rozwiązaniem ostatniej deski ratunku. Polecam przypadkowym widzom z Zachodu, aby poszukali na przykład Xiang Yu lub Ren Tu (rzeźnika ludzi), a nawet kampanii Zhuge Liang. Mogę również odnieść się do bohaterskich generałów Yang z Southern Song jako do dzielnych postaci chińskiej historii wojennej. Chiński bóg wojny (Guan Yu) jest nadal czczony przez funkcjonariuszy policji i żołnierzy z pierwszej linii do dziś. Dopiero po pacyfizmie okresu post-Ming Chiny zyskały reputację bogatego, ale słabego narodu.
Nie ma na świecie kraju, który mógłby tak chętnie wydawać swoich ludzi jak paszę i by ludzie byli gotowi tak wydać, może z wyjątkiem ziemi Rusi, naszych okrutnych braci z Północy. Jeśli jankesi przybędą do Tai Wan, niebiański mandat będzie dyktował, że krew Chińczyków zmyje cudzoziemców jak czerwona fala. Krew będzie dana za darmo, bezlitośnie i obficie. Chińska ziemia na zawsze pozostanie chińską ziemią.
Jestem chińczykiem. Jestem też Amerykaninem. Pokój dla wszystkich. Pokój na Ziemi.
Nad Wisłą rodzi się nowe … sierp i młot zastępowane są banderowskimi symbolami … kraj tryzubi się … Tak sobie myślę prywatnie … a kiedyś katolicki był … z ruskimi pierogami …
Schizofrenia nad Niemnem , Wisłą i Odrą czyli entropia używana ( z drugiej ręki )
„Niestety w czwartym gemie uderzał tak fatalnie, że stracił gema i przegrał seta, a po tym blamażu nie mógł się już odnaleźć. Piąty set dla naszego zawodnika powinien być obowiązkowy.
Po południu na kort wyszła Iga Świątek. Nie grała źle, ale robienie min po nieudanych zagrywkach nie przystoi zawodniczce znajdującej się na czele rankingu WTA.
…………………….
” W przedchorobowej linii życia chorych na schizofrenię często obserwuje się
niedostatek zabawy w ich stosunkach z otoczeniem. ”
Dziewcząt tudzież darowanych Schizy i Frenii, nie zwracam… „
https://thesaker.is/chinese-foreign-ministry-spokesperson-zhao-lijian/
========
„Chińczycy trzymają się mocno”….
Zachód zaś, bawi się w trzy małpki.
Nie widzę, nie słyszę, nie chcę wiedzieć.
Za to dużo gadam, zagłuszając narracją rzeczywistość.
Czy to schizofrenia, czy perserweracja?
https://kodluch.wordpress.com/2022/05/29/29-05-2022-syria-2428-dzien-sprzatania-swiata/
======
Garść przydatnych linków dla interesujących się polityką.
I FAKTAMI których interpretacja nie pochodzi z głównych szczekaczek.
Kilka godzin czytania wystarczy, by zmienić swój obraz swiata.
Życie w MATRIXIE niekoniecznie jest tym realnym.
Miłuj nieprzyjaciół … ! Tak sobie myślę prywatnie … w Unii to towar deficytowy … bierze odwet za Stalingrad …
@mfizyk:
Same się puszczają. Czasem, na weekend, przyjdzie gajowy i wyrzuci ze 100, czy 200 komentarzy. Ale tak, w dni robocze, komentarze działają jak tablica ogłoszeniowa dla ludzi ze słowotokiem…
Procedura ta odpowiadała orientacji politycznej i społecznej nowego państwa. Już w 1990 roku, na początku fazy słabości państwa jugosłowiańskiego, władzę przejęły siły ultranacjonalistyczne i prawicowe. Dołączyli do nich antykomunistyczni chorwaccy emigranci z Kanady, USA, Austrii i Niemiec, którzy uciekli tam w czasach socjalistycznej Jugosławii. Wielu z nich odnosiło się do osławionego Czarnego Legionu, Ustaszy, odpowiedzialnego za liczne zbrodnie na Serbach i partyzancie komunistycznym w latach 1941-1945 wraz z Wehrmachtem i SS w faszystowskiej Chorwacji, która wówczas przez krótki czas istniała pod ochroną niemiecką. Miejscem spotkań wszystkich tych sił w nowym państwie stała się Chorwacka Unia Demokratyczna (HDZ).
https://overton-magazin.de/krass-konkret/das-vorbild-jugoslawien-von-der-krajina-zu-donezk-und-lugansk/
========
Dzieciom we mgle dezinformacji….
@Herstoryk
Na Zachodzie biada się nad niecałkiem prawdziwym losem Biblioteki Aleksandryjskiej, podczas gdy prawdziwa katastrofa dla wiedzy – w Bagdadzie jest pomijana i zapomniana.
Smutne to ale taki jest los kultury popadłej w zastój. Zainteresowanie swoją historią budzą kraje dynamiczne, rozwijające nowe technologie, z rosnącym udziałem w handlu międzynarodowym. Jako przykład widzę Japonię, wokół historii i kultury której zainteresowanie rosło w miarę jak się gospodarczo rozwijała.
Mam zastrzeżenie co do “prawdziwej katastrofy dla wiedzy”. Niewątpliwie zniszczenie biblioteki w Bagdadzie było katastrofą dla wiedzy ale skąd wiadomo, że większą niż inne podobne skoro nic nie pozostało z jej zbiorów?
Co za mecz!!!
Rewelacja!!!
W przeciwieństwie do Zełeńskiego prezydent Hacha wybrał ochronę życia mieszkańców Czechosłowacji … Tak sobie myślę prywatnie … to nie był czeski błąd …
Zverev vs Alcaraz 3:1 (to ten super mecz)
Teraz Novak Djokovic vs Rafael Nadal
Po północy w Paryżu
To nie tytuł filmu, to koniec ćwierćfinałowego meczu tenisowego Wielkiego Szlema w którym Rafael Nadal pokonał Novaka Djokovicia 3:1.
Zaczęli w maju, skończyli w czerwcu. Dzisiaj dzień dziecka
Dobranoc!
@Redes22 31 maja 2022 17:31
„@Herstoryk
Na Zachodzie biada się nad niecałkiem prawdziwym losem Biblioteki Aleksandryjskiej, podczas gdy prawdziwa katastrofa dla wiedzy – w Bagdadzie jest pomijana i zapomniana.”
Smutne to ale taki jest los kultury popadłej w zastój. […]
Mam zastrzeżenie co do “prawdziwej katastrofy dla wiedzy”. Niewątpliwie zniszczenie biblioteki w Bagdadzie było katastrofą dla wiedzy ale skąd wiadomo, że większą niż inne podobne skoro nic nie pozostało z jej zbiorów?
Cywilizacja islamu zaczęła zjeżdżać w zastój właśnie pod wpływem najazdu Mongołów. Nie miejsce tu i nie czas detalicznie to wykładać, ale z upadkiem tytularnego już wtedy ale jednak wciąż symbolicznie ważnego kalifatu bagdadzkiego Abbasydów islamskim elitom zawalił się ideowo i politycznie świat. Od czego niektórzy głośni i wpływowi dostali ideowego kręćka i „odnaleźli (fundamentalistyczną) religię”. Co w połączeniu z utratą ksiąg mogło przyczynić się do tego zastoju.
Interesujący artykuł nt. Why the Arabic World Turned Away from Science.
Nie wiadomo oczywiście, czy największą katastrofą, ale cywilizacja islamskiego Złotego Wieku była pierwszą w pewnym sensie globalną, z centrum leżącym pomiędzy rzymsko-bizantyńską, perską, indyjską i chińską, czerpiąc, korelując i korygując idee pochodzące z ich dorobków. Po drugie, pierwszą w której zastosowano na masową skalę i w zorganizowany sposób naukową (empiryczną) metodę weryfikacji tych idei. Można więc bezpiecznie dedukować, że gwałtowny skokowy wzrost entropii gromadzonych przez 500 lat bagdadzkich księgozbiorów naukowych był jedna z największych, o ile nie największą (jak dotąd) katastrofą dla wiedzy.
Rozbitą szklankę łatwo zastąpić inną. Zniszczonej wiedzy już nie.
Gdzie jest Dezerter?
„Sara i Edwin byli świadkami Jehowy. ‘Odkąd pamiętam, Armagedon był tuż za rogiem’”
Natalia Kondratiuk-Świerubska, Gazeta Wyborcza 30.05.2022 17:27
- Mam wrażenie, że jako eks-świadkowie zmagamy się z pewnego rodzaju stresem pourazowym. Przez lata, niemal od wczesnego dzieciństwa, programowano nas, by wyczekiwać wieści wojennych, epidemii, kryzysów na świecie. Odkąd pamiętam, Armagedon był tuż za rogiem i każda wiadomość w mediach to był znak, że to już zaraz, za chwilę – mówi Sara, która przez wiele lat należała do organizacji świadków Jehowy. (…)
Sara: Urodziłam się w rodzinie świadków Jehowy i dorastałam w tej indoktrynacji. Moi rodzice zabierali mnie i brata na zebrania, które w latach 1990-tych odbywały się jeszcze trzy razy w tygodniu oraz na większe zgromadzenia. Staraliśmy się też, jako rodzina, przynajmniej raz w tygodniu wyruszać do służby, czyli chodzić od domu do domu by mówić innym o Jehowie – w tym celu ćwiczyliśmy wstępy, przygotowaliśmy sobie odpowiednie publikacje i uczyliśmy się, jak mamy odpowiadać, gdy domownik nie będzie zachwycony naszym widokiem. Na przykład, gdy powie: „ja już mam swoją religię”.
Chociaż normalnie chodziłam do szkoły i widziałam inne dzieci, to jednak wciąż z różnych stron słyszałam, że organizacja to prawda, wkrótce przyjdzie Armagedon i Jehowa zniszczy złych ludzi. Uwierzyłam w to, chociaż dzisiaj trudno mi określić, na ile wpłynęło na to środowisko, a na ile mój charakter i pewna idealistyczna wizja świata, której dałam się skusić jako nastolatka. (…)
Z Edwinem poznaliśmy się po „świadkowsku” – mijaliśmy się tu i tam, ponieważ nasze zbory sąsiadowały ze sobą. Jednak bliżej poznaliśmy się w ośrodku pionierskim. Kiedyś organizowano obozy dla świadków. Wyglądało to tak, że grupa świadków (oczywiście pod nadzorem wybranego mężczyzny – nadzorcy), jechała na teren z potrzebami, czyli tam gdzie jest mało świadków lub tam, gdzie miejscowi nie wyrabiają z ogłoszeniem całego terenu. Przez tydzień lub dwa chodzi się codziennie na kilka godzin na głoszenie, ale poza tym atmosfera przypomina trochę obóz harcerski: spało się w namiotach, jeździło na rowerach, chodziło nad jezioro i śpiewało przy ognisku pieśni królestwa (są to pieśni religijne świadków Jehowy – red).
Edwin: Zacznijmy może od tych wyższych wymagań. Mamy więc pioniera stałego, który zobowiązuje się do 840 godzin rocznie, co daje mniej więcej 70 godzin miesięcznie. Za naszych czasów można też było zostać pionierem pomocniczym na jeden lub kilka miesięcy. Zobowiązywano się wówczas do głoszenia 50 lub 30 godzin miesięcznie. Obecnie przez pandemię wprowadzone pewne zmiany w tym zakresie, ale przyznaję, że nie śledziłem tematu.
Sara: W naszym zborze mawiano, że dobrze jest pracować na średnią zboru. Jeśli więc średnia głoszenia w zborze wynosiła 10 godzin miesięcznie, to te osoby, które chciały być znane, jako duchowo usposobione, albo mieć jakieś funkcje w zborze starały się oddawać sprawozdanie z większym wynikiem. Oczywiście świadkowie lubią podkreślać, że to sprawozdanie, tak zwany „owoc”, jest dobrowolne i głosimy z serca oraz miłości do ludzi i do Jehowy… Jednak, jeśli nie składasz nawet tego minimalnego kwadransa miesięcznie dostajesz łatkę nieczynnego głosiciela, a tym samym reszta społeczności wie, że nie jesteś dobrym duchowo towarzystwem.
Edwin: Warto tu wspomnieć, że jako dzieci nie składaliśmy takiego sprawozdania, bo mogą to robić tylko głosiciele. Sara miała chyba z 10 lat, jak została głosicielką, ja również. Do tego czasu nasz udział na głoszeniu zależał głównie od gorliwości naszych rodziców: towarzyszyliśmy im i uczyliśmy się, jak głosić.
kobieta.gazeta.pl/kobieta/7,107881,28458270,sara-i-edwin-odeszli-od-swiadkow-jehowy-ktos-mi-bliski-stal.html#s=BoxWWImg4Mauro Rossi 30 MAJA 2022 21:32
Kiedy po raz pierwszy zaczęliście odczuwać, że coś w tej organizacji jest nie tak?
Sara: Bardzo często słyszę to pytanie i nie wiem, jak na nie odpowiedzieć. Mam wrażenie, że ludzie szukają tajemniczego czynnika X, który sprawi, że z organizacji odejdzie ich siostra, mama czy chłopak, a tak nie jest. Lubię porównywać wybudzanie do układania puzzli. Zbieramy pewne elementy przez miesiące, lata i dopiero widok z góry na całość pozwala nam dostrzec pełny obraz.
Z dzisiejszej perspektywy dużo do myślenia daje mi to, jak bardzo nieszczęśliwa byłam. Już od czasów nastoletnich zmagałam się z myślami samobójczymi, a jednocześnie byłam przekonana, że należę do grona najszczęśliwszych osób na ziemi. Rozmawiałam ze znajomymi pionierkami (również ze zdiagnozowanymi depresjami), które wzdychały z bólem powtarzając: niech już przyjdzie koniec i skończy się ten świat i byłam w pełni przekonana, że ludziom wokół jest jeszcze gorzej. Być może diagnoza, leki i terapia pomogłyby mi również, gdybym nie odeszła z organizacji, ale cieszę się, że nie ryzykowałam sprawdzenia tego.
Edwin: Pierwszy zgrzyt pojawił się, gdy w szkole średniej omawialiśmy temat zburzenia Jerozolimy. Byłem bardzo pewny siebie, bo ten temat pojawia się w wielu publikacjach i jest jakby podstawą wierzeń doktrynalnych świadków Jehowy. Nie uczyłem się więc do lekcji, tylko butnie zgłosiłem się i powiedziałem, że Jerozolima została zburzona w 607 roku przed naszą erą. Na to nauczyciel mnie usadził, bo jednak wszelkie źródła historyczne mówią o 587 roku. Wdałem się nawet w lekką kłótnię z nauczycielem, tak byłem pewny swego.
Ta data jest z pozoru błaha, ale gdyby to nie był 607 rok, to cała nauka świadków się sypie: w 1914 nie zostaje strącony Szatan z nieba na ziemię, Jezus nie zaczyna panować w 1914 i tym samym „to pokolenie”, czyli osoby które pamiętają ten rok 1914 nie może przeminąć – bo przecież nie chodzi o ten rok. Podstawowa doktryna świadków Jehowy – upada. … Jednak wiara w organizację i jej nauki była tak silna, że uznałem, że nie ma jeszcze odkrytych źródeł historycznych, które potwierdziłyby 607 rok. Na pewno w pewnym momencie archeolodzy odkryją dowody i wyjdzie na jaw, że to świadkowie z Biblią przez cały czas mieli rację. I tak czekałem 10 lat robiąc jednocześnie karierę w zborze.
Kiedy zdecydowaliście się na odejście?
Sara: Decyzja o oficjalnym odejściu nie przychodzi łatwo i myślę, że to dość dobrze pokazuje, jak bardzo organizacja wpływa na bardzo prywatne sfery życia. Dla mnie jest to właśnie jeden z tych elementów, który cechuje grupę destrukcyjną.
Edwin: Nie odeszliśmy więc od razu, chociaż praktycznie z dnia na dzień przestaliśmy brać udział w zborowych aktywnościach, co rodziło pewne pytania w społeczności i wiązało się niemal z prowadzeniem śledztwa na nasz temat. Nie chciałem rozmawiać ze starszymi i unikałem spotkania z nimi, ale w końcu odwiedzili mnie w pracy i nie dali się tak łatwo zbyć. Jakoś udało nam się załagodzić sprawę – gdybyśmy wtedy wprost powiedzieli o naszych wątpliwościach, najprawdopodobniej od razu czekałoby nas wykluczenie za odstępstwo i tym samym stracilibyśmy kontakt z każdym w zborze, nawet z członkami rodziny.
Sara: W tamtym momencie nie wiedziałam, jak długo będziemy próbować zachować status oficjalnego świadka. Mnie osobiście męczyło ukrywanie się – mieszkamy w centrum naszego niedużego miasta i często mijałam świadków stojących z wózkiem na głoszeniu. Nie chciałam się tłumaczyć, z tego, co u mnie słychać i dlaczego nie chodzę na zebrania. Wstępnie postanowiliśmy poczekać do wesela w rodzinie, żeby nie tworzyć podziałów i po tym wydarzeniu przeszłam duże załamanie. Paradoksalnie mnie ludzie traktowali normalnie, ale poszła plotka, że Edwin ma odstępcze poglądy – chyba myślano wtedy, że mi zakazuje chodzenia na zebrania – bardzo ubodło mnie, jak nagle stał się niewidzialny dla dawnych przyjaciół. Do czasu, gdy nie polał się alkohol, wtedy już można było z nim rozmawiać. Po powrocie do domu postanowiłam, że nie chcę dłużej udawać i opublikowałam wpis na blogu, w którym opisałam, dlaczego nie chcę już być świadkiem.
Edwin: Śmieszne jest to, że po tym nagle znów stałam się widzialny, bo wyszło niby, że to Sara jest tą złą stroną. Jednorazowo oferowano mi nawet „pomoc duchową”, ale na szczęście na tych ofertach się skończyło. Nie czułem potrzeby oficjalnego odejścia, bo już nie uważałem, że to jest moje prawo, którego mam przestrzegać. Dopiero pół roku po Sarze, gdy znów zaczęły się telefony z ultimatum, że mam usunąć z naszego sklepu internetowego naklejki na drzwi, żeby świadkowie nie odwiedzali danego mieszkania, a jeśli tego nie zrobię, to mam się stawić na komitet sądowniczy (to procedura wewnętrzna w zborach świadków Jehowy, której celem jest ustalenie, czy wyznawca żałuje popełnienia ciężkiego grzechu – przyp.red.).
Jak zareagowali na odejście wasi bliscy? Czy obecnie macie z nimi kontakt?
Sara: Mieliśmy dużo szczęścia, bo praktycznie od zawsze miałam bliskie relacje z moją rodziną, która nie była w organizacji. U Edwina sporo osób była wykluczonych wcześniej. Trochę baliśmy się, czy będziemy mogli mieć oficjalne kontakty z moim bratem i rodzicami, ale na szczęście udało się. Brat odszedł miesiąc po mnie, rodzice rok później, a że poglądy mieli podobne do naszych, to spotykaliśmy się normalnie.
Edwin: W moim przypadku wkradł się mały cień, bo jedna z bardzo bliskich mi osób jest nadal aktywnym świadkiem i te relacje już nie wyglądają tak jak kiedyś. To boli, bo gdy nie dbasz o kontakt z drugą osobą, ta relacja obumiera. Patrzę czasem z lekką zazdrością na Sarę i jej brata, gdy się przedrzeźniają i z żalem myślę, że ktoś mi tak bliski stał się obcą osobą.
A jaka była reakcja innych świadków?
Sara: Błyskawiczna. Najpierw telefon od starszych, czy podtrzymuję to, co napisałam. Chyba jeszcze tego samego tygodnia zostało ogłoszone, że nie jestem już świadkiem Jehowy. Spodziewałam się tego, że dawni znajomi pousuwają mnie z Facebooka czy tego, że nie będą się do mnie odzywać na ulicy. Chociaż to i tak jest na początku dziwne i trochę czasu minie, zanim się do tego przyzwyczaisz. Jesteśmy zwierzętami stadnymi, potrzebujemy społeczności. Normalnie, gdy idziesz do sklepu, zdarza się ci się wdać z kimś w jakieś pogawędki. A tu nagle jesteś po prostu obcą osobą. Jesteś niewidzialny, bo świadkowie specjalnie odwracają wzrok i wkładają sporo energii, by cię nie dostrzegać. Zdziwiła mnie otwarta wrogość jednej osoby oraz plotki. Osoby, z którymi kiedyś byłam blisko, nie mogły zrozumieć, że odeszłam na podstawie samodzielnie podjętych wniosków i rozpowiadały, że wykluczono mnie za zdradę małżeńską.
Edwin: Uśmiałem się, gdy usłyszałem jak jeden znajomy powiedział: „ale ta Sara Edwinowi zrobiła”, bo odeszła przede mną. U mnie nie było tak gwałtownych reakcji. Część osób podejrzewała, że mogę odejść więc profilaktycznie zrywali kontakty (na przykład zawodowe) wcześniej. Postanowili profilaktycznie przenosić strony internetowe do innego brata ze zboru, bo opłacenie raz w roku faktury, to by było za duże obciążenie dla ich sumienia. Żalu nie mam, bo mamy wolny rynek, ale trochę to dziwne było.
Z jakimi trudnościami mierzyliście się po odejściu z organizacji?
Sara: Gdy coś się działo w moim życiu nie tak, miałam takie myśli, że to jakiś rodzaj kary, że może byłoby inaczej, gdybym nie odeszła z organizacji. Mam wrażenie, że jako eks świadkowie zmagamy się z pewnego rodzaju stresem pourazowym. Przez lata, niemal od wczesnego dzieciństwa programowano nas, by wyczekiwać wieści wojennych, epidemii, kryzysów na świecie – odkąd pamiętam Armagedon był tuż za rogiem i każda wiadomość w mediach, to był znak, że to już zaraz, za chwilę. W świecie dzisiejszych mediów bardzo łatwo uruchamiają się te mechanizmy.
Edwin: Myślałam, że nie znajdę przyjaciół, bo byłem bardzo samotny, bo nie miałem żadnych relacji poza zborem. Uważałem, że w takim wieku to już niemożliwe – byłem pewny, że przyjaciół mogłem poznać tylko w organizacji i tylko w młodym wieku. Po pewnym czasie postanowiłem jednak zastosować „świadkowską metodę” i do jednego z moich klientów, gdy życzył mi wesołych swiąt, powiedziałem, że dziękuję, bo w tym roku postanowiłem obchodzić święta, bo to ważny moment. Metoda „świadkowska”, bo zachęcano nas, by w taki sposób wykorzystywać okazje do głoszenia np. gdy ktoś nam życzy wesołych świąt, odpowiadamy, że postanowiliśmy ich nie obchodzić i zdziwiony rozmówca pyta dlaczego, a my lecimy z propagandą. Piotr dał się złapać i dzisiaj nadal bardzo się przyjaźnimy.
A co was zaskoczyło najbardziej w świecie „poza organizacją”?
Sara: To, że świat nie jest taki zły, nawet jeśli nie kwitną jabłonie. Pamiętam, jak poszliśmy na pierwszą imprezę z ludźmi spoza organizacji i to wielkie zdziwienie, że alkohol pito z umiarem, można było potańczyć, pożartować i w sumie, to czasem na świadkowskich imprezach były gorsze sytuacje.
Edwin: Zaskoczyło mnie to, że ludzie są gotowi sobie pomagać bezinteresownie. Organizacja trochę przedstawiała nam obraz, że tylko w zborze jest taka pomoc. Powtarzano nam też, że gdy ktoś postanowił rzucić palenie lub inny nałóg, to udało mu się to dzięki pomocy Jehowy. Ze zdziwieniem odkryłem, że świadkowie nie mają na to monopolu – w innych grupach religijnych również są struktury, które pomagają uzależnionym, a co więcej nie stosują wobec osób z problemami ostracyzmu.
Jak z obecnej perspektywy oceniacie wpływ organizacji na wasze życie i osobowość?
Edwin: W pewien sposób musiałem się dopiero nauczyć życia „w świecie”. W pewnym sensie jest to jak wyjście z więzienia, ponieważ organizacja totalitarnie wpływa na każdy aspekt twojego życia. Zaczynając od tego, jaką pracę wybierzesz, czy pójdziesz na studia, czy przyjmiesz jakiś lek lub odmówisz transfuzji i umrzesz, aż do tego, że zakazuje ci kontaktów z rodziną i znajomymi, jeśli przestali być świadkami.
Sara: Po 4 latach dużo już się nauczyliśmy życia w tym „świecie” i czasem trudno mi ocenić, na co wpłynęła organizacja, a na co moje usposobienie. Udany weekend to dla mnie nadal raczej spokojny czas z książką, a nie hulanki i swawole. Musiałam to w sobie przerobić i zaakceptować: jedni odchodzą z organizacji i wreszcie mogą się rozwieść i ułożyć sobie życie i to jest ok, ale nasza nudna, stateczna rutyna też jest w porządku. Zrozumiałam, że nie muszę imprezować do rana, by nadal być zadowolona z życia „w świecie”.
Wasz kanał na youtubie cieszy się dużą popularnością. Czy w związku z tym odzywają się do Was osoby, które są świadkami i chciałyby odejść z organizacji, ale się tego boją?
Sara: Tak, regularnie. Często chcą gdzieś wyrzucić swoje emocje i złość, którą czują. Sprawy nie ułatwia to, że na samym początku trudno sobie wyobrazić życie bez organizacji. Do tego dochodzi lęk przed utratą rodziny i znajomych. Dlatego też, wielu świadków po prostu latami udaje, że nadal w to wszystko wierzy – byle by tylko nie stracić żony, dzieci, rodzeństwa czy rodziców. Ponieważ świadkowie bardzo dosłownie traktują zasadę zrywania relacji z osobami, które odchodzą z organizacji. Mamy też kontakt z osobami, które napisały do nas tę pierwszą wiadomość, czując ogromny lęk – bo przecież piszą do „odstępców” – a dzisiaj są już szczęśliwi poza zborem. I to odejście nie jest w sumie, tylko naszą zasługą.
Edwin: Tak, bo wychodzenie z grupy destrukcyjnej to dość złożony proces. My troszkę postrzegamy naszą działalność w internecie, jako taki brakujący puzelek w czyjejś układance. Czasem jedno zdanie, które wypowiemy my albo nasi rozmówcy, tak bardzo mocno rezonuje z jakąś osobą, że dostrzega ona jak naprawdę wygląda jej życie – ciągłe poczucie winy, rezygnacja z marzeń, celów i pasji – oraz dostrzega totalitarne oddziaływanie grupy, do której należy – na każdą dziedzinę jej życia.
Wolność, którą taka osoba wybiera, często ma gorzką cenę w postaci zerwanych więzi z bliskimi. W naszych materiałach na youtubie oraz w mediach społecznościowych, staramy się pokazać takim osobom, że po podejściu życie może być naprawdę wspaniałe. Gdy te osoby nabiorą odpowiednich sił psychicznych – często dzięki pomocy specjalisty, zbudują relację poza zborem, bo uwierzą, że jest to możliwe oraz poczują, że „świat nie jest taki zły” jak przedstawiała organizacja, są gotowe zapłacić tę cenę.(…)
Całość tu: https://kobieta.gazeta.pl/kobieta/7,107881,28458270,sara-i-edwin-odeszli-od-swiadkow-jehowy-ktos-mi-bliski-stal.html#s=BoxWWImg4Mauro Rossi 30 MAJA 2022 21:32
Herstoryk 1 CZERWCA 2022 2:24
Racja i dobra odpowiedź chrześcijańskim rasistom i ksenofobom.
Przypominam, że Biblioteka Aleksandryjska (gr. Βιβλιοθήκη τῆς Ἀλεξάνδρειας, łac. Bibliotheca Alexandrina) była to największa biblioteka świata starożytnego, istniejąca w Aleksandrii a założona przez Ptolemeusza I Sotera. Miała ona burzliwe dzieje. Biblioteka Aleksandryjska powstała w szczególnym okresie rozwoju starożytnej nauki i przez długi czas gromadziła cenne zbiory z różnych obszarów wiedzy. Przyjmuje się, że biblioteka działała przy Muzeum Aleksandryjskim do IV wieku n.e. W istocie jednak biblioteka ta była podzielona na dwie części. Na terenie pałacu królewskiego, dostępnego oczywiście tylko dla nielicznych, mieścił się główny zbiór. Korzystać z niego mogli przede wszystkim uczeni. Druga część biblioteki była dostępna publicznie i znajdowała się w tak zwanym Serapejonie (Serapeum), czyli w świątyni Serapisa. Na terenie tej biblioteki – dziś moglibyśmy powiedzieć o niej jako o „filii” biblioteki głównej – znajdowały się dzieła ogólnodostępne i zwoje służące celom edukacyjnym. Korzystali z nich mieszkańcy miasta.
Kilka dekad p.n.e. zbiór główny („pałacowy”) został zniszczony przez wojska Juliusza Cezara (dostało mu się później za to) podczas działań wojennych, ale „dobiło” ją to, że bardzo przeszkadzała chrześcijańskiemu patriarsze aleksandryjskiemu, niejakiemu Teofilowi (385–412), który zniszczył Serapeum, drugą część Biblioteki Aleksandryjskiej, gdzie przeniesiono większość dokumentów z pierwotnej biblioteki. Tłum chrześcijan zniszczył wtedy „w imię boga” stare rzeźby, dzieła sztuki i spalił rzadkie książki. :-(
Optymatyk 31 MAJA 2022 20:24 (inny blog)
Racja! Ateizm, jako taki, jest naturalnym stanem człowieka, wszystkich ludzi. Dopiero na końcu przyszła wymyślona przez człowieka (ludzi) religia i wszyscy czczeni w niej bogowie, bożkowie, boginie i boginki. Taki stan umysłu jest rezultatem zniekształceń (degeneracji) mózgowych wyznawców, powstałych w wyniku odejścia od właściwego dla naszego gatunku życia biologicznego. Najlepiej ujął to prof. J. Aleksandrowicz: „Wszelkie trudności gospodarcze, społeczne, polityczne, a także wszystkie choroby mają swoją przyczynę w wadliwej strukturze i w wadliwej czynności mózgów ludzkich, a ta wadliwa struktura i wadliwa czynność mózgów u wszystkich (prawie) ludzi była i jest spowodowana czynnikami EKOLOGICZNYMI”. Czyli zewnętrznymi. Czyli nie genetycznymi. Czyli możliwymi do usunięcia. Zatem w czynnikach środowiskowych, zwanych ekologicznymi, trzeba szukać tej wadliwej struktury i wadliwej czynności ludzkich mózgów.” Poza tym, to wiara czyni człowieka głupim.
Im dłużej trwa wojna na Ukrainie, tym bardziej owa Ukraina popada w ruinę. A przecież dziś, to nikogo na pogrążonym w kryzysie gospodarczym i społecznym Zachodzie nie jest i nie będzie stać na jej odbudowę i nikt tam nie jest w takiej odbudowie zainteresowany. Ale przeciąganie tej wojny jest w interesie Zachodu, gdyż im dłużej ona trwa, tym więcej może tam ów Zachód „upłynnić” swoich nadwyżek broni.
Natomast popieranie w tej wojnie przez Polskę banderowców i okupantów Lwowa, jest wielkim błędem obecnego warszawskiego, zdradzieckiego (nie mylić z radzieckim) reżimu.
@STANISŁAW SŁOWIANIN:
> W przeciwieństwie do Zełeńskiego prezydent Hacha
Hacha miał 66 lat, był schorowany, a Czechy były otoczone przez wrogów, jeśli doliczyć chcących się odłączyć Słowaków. Przy tym większość życia Hachy upłynęła w C-K Monarchii i „germańską zwierzchność” nad Czechami uważał on za stan naturalny.
Zełeński ma 44 lata, Ukraina ma szerokie wsparcie na Zachodzie (i południu); większość życia Zełeński spędził w niepodległej Ukrainie, jej wolność uważa więc za stan naturalny.
Porównujesz nieporównywalne.
> … to nie był czeski błąd …
Czesi nie wyszli na tym źle, ale tylko dlatego, że wkrótce potem zaczęła się wojna, którą III Rzesza przegrała, dzięki czemu nie zdążyli się załapać na wysiedlenia Słowian z ziem germańskich. Ale z tego co zdążyłem się zorientować, to wcale nie sugerujesz, że Ukraina powinna się taktycznie poddać i wrócić do niepodległości, gdy inne kraje załatwią wojnę za nią i zburzą Moskwę?
Poza tym, to wierzący są osobnikami z definicji amoralnymi, na dodatek żyjącymi w ciągłej niepewności, co do tego, jak zostaną zakwalifikowane ich uczynki i myśli, gdyż nie ma przecież czegoś takiego jak odpuszczenie grzechów przez innych ludzi, jako iż grzechy odpuścić może tylko bóg, bogini lub bogowie. Oczywiste też jest, że te istoty iście z bajek i innych klechd ludowych, istnieją tylko w chorych umysłach ich wyznawców. Natomiast ateiści wiedzą, że żadna istota nadprzyrodzona nad nimi nie stoi a więc patrzą trzeźwo na świat i się nie stresują.
PAK4 1 CZERWCA 2022 8:24
Pamietaj, że im dłużej trwa wojna na Ukrainie, tym bardziej owa Ukraina popada w ruinę, ale dziś to nikogo na pogrążonym w kryzysie gospodarczym i społecznym Zachodzie nie jest i nie będzie stać na jej odbudowę i nikt tam nie jest też w takiej odbudowie zainteresowany.
Jednakże przeciąganie tej wojny jest w interesie Zachodu, gdyż im dłużej ona trwa, tym więcej może tam ów Zachód „upłynnić” swoich nadwyżek broni. Natomiast popieranie w tej wojnie przez Polskę banderowców i okupantów Lwowa, jest wielkim błędem obecnego warszawskiego, zdradzieckiego (nie mylić z radzieckim) reżimu.
PAK4 1 CZERWCA 2022 8:24
„większość życia Zełeński spędził na niepodległej Ukrainie”. Z kogo ty tu sobie żarty robisz?
@kalvarya01:
Masz rację — oczywiście, miało być „większość życia Zełeński spędził w niepodległej Ukrainie”.
Szanowni Szaleni Naukowcy,
Pamiętajcie, że łaska pańska na pstrym koni jeździ. Taki np. Tusk to strasznie starał się i wchodził Niemcom w te przysłowiowe 4 litery ale i tak wyrzucili go z prezydentury unijnej i ze stanowiska szefa unijnej centroprawicy, choć przecież mogliby zrobić dla niego wyjątek i przedłużyć jego kadencje na w/w synekurkach…
PAK4 1 CZERWCA 2022 9:11
Pa polski nie mówi sja „w Ukrainu”, pa polski mówi sja „na Ukrainu”.
Walki szalały w Siewierodoniecku we wtorek, gdy wojska rosyjskie zbliżały się do centrum miasta, które jako ostatnie w obwodzie ługańskim na wschodzie Ukrainy pozostaje poza kontrolą Rosji.
Nowojorskie Czasy
PAK4 1 CZERWCA 2022 9:11
Kiedy to Ukraina była nieodległa? Krótko podczas i po I WŚ, kiedy to w roku 1917, 20 listopada, na obszarze niektórych dawnych „małoruskich” guberni Imperium Rosyjskiego, ale bez Krymu, powstała w ramach federacji z Rosją tzw. Ukraińska Republika Ludowa, która ogłosiła pełną niepodległość 25 stycznia 1918 roku. Bolszewicy próbowali przejąć władzę w Kijowie równolegle do przewrotu w Piotrogrodzie. Zostało to jednak uniemożliwione przez oddziały lojalne wobec Ukraińskiej Centralnej Rady, która 20 listopada 1917 roku proklamowała niepodległość tzw. Ukraińskiej Republiki Ludowej w związku federacyjnym z Rosją. Na Ukrainie odbyły się w końcu listopada 1917 r. wybory do rosyjskiego Zgromadzenia Ustawodawczego (Konstytuanty). 24–25 grudnia 1917 roku w Charkowie bolszewicy stworzyli zaś tzw. Ukraińską Ludową Republikę Rad (nazwa świadomie zbliżona do tzw. Ukraińskiej Republiki Ludowej. Po rozpędzeniu w Piotrogrodzie 19 stycznia 1918 roku Zgromadzenia Ustawodawczego (po jednym dniu obrad) przez bolszewików, 25 stycznia 1918 roku Ukraińska Centralna Rada ogłosiła pełną niepodległość tzw. Ukraińskiej Republiki Ludowej (URL). Oddziały bolszewików rozpoczęły wówczas ofensywę na terytorium tejże URL i 8 lutego 1918 roku zajęły Kijów. Po zawarciu traktatu brzeskiego jej terytorium znalazło się pod okupacją wojsk niemieckich i austro-węgierskich, zaś RFSRR była zmuszona uznać niepodległość tzw. Ukraińskiej Republiki Ludowej i 14 czerwca 1918 roku zawrzeć z Hetmanatem (nazwa państwa ukraińskiego powstałego pod protektoratem niemieckim) zawieszenie broni, preliminaryjne do traktatu pokojowego. W latach 1918–1920 Kijów znajdował się kolejno we władaniu tzw. Ukraińskiej Republiki Ludowej, tzw. Hetmanatu, ponownie URL, bolszewików, Armii Ochotniczej gen. Antona Denikina, ponownie URL, bolszewików, Wojska Polskiego i URL, aby od 13 czerwca 1920 roku ostatecznie znaleźć się w rękach radzieckich. W dniach 5–12 lipca 1918 roku utworzony został ukraiński oddział RKP(b) – KP(b)U.
Także krótko w roku 1941, kiedy to OUN ogłosiła we Lwowie 30 czerwca tegoż roku tzw. akt odnowienia państwa ukraińskiego. Obie frakcje nacjonalistyczne OUN były gotowe w 1941 roku do współpracy z Niemcami przeciwko ZSRR w celu uzyskania autonomii bądź niepodległości Ukrainy. Jednakże po niepowodzeniu próby ogłoszenia niepodległości OUN-B przeszła do podziemia i utworzyła jesienią 1942 partyzantkę – Ukraińską Powstańczą Armię, która toczyła walkę z partyzantką polską i radziecką oraz niemiecką administracją okupacyjną i niemieckimi siłami policyjnymi, a po okupacji terenów Wołynia i Galicji Wschodniej – z oddziałami Armii Czerwonej i NKWD. UPA w latach 1943–1944 dokonała czystki etnicznej – masowej zbrodni ludobójstwa na polskiej ludności cywilnej na terenie obecnej zachodniej Ukrainy (Wołyń, Galicja Wschodnia). OUN była także politycznym promotorem powstania w 1943 roku Dywizji SS-Hałyczyna (Galizien).
PAK4 1 CZERWCA 2022 9:11
„NiePodległa” – nieodległa od nas była ona zawsze i niestety jest dalej. :-(
PAK4 Ochrona życia ważniejsza niż terytorium … dlatego jankesi zamknęli rdzenną ludność w rezerwatach w zamian za ich terytorium … Tak sobie myślę prywatnie … takie coś za coś … ochrona życia poczętego aż do naturalnej śmierci …
@SŁOWIANIN STANISŁAW:
> Ochrona życia ważniejsza niż terytorium
Bardzo niesłowiańska maksyma 😉
Swoją drogą, ukatrupić Putina i osiągniesz ideał „ochrony życia” wielu ludzi. Tylko jakoś dziwnym trafem wolisz rozwiązanie, które pozwala mu mordować innych…
@kalvarya01:
Jeśli twierdzisz wyraźnie i autorytatywnie coś innego, niż RJP, oraz ignorujesz 30 lat niepodległości Ukrainy; bujasz się między pretensjami do ścisłego rozróżnienia entropii i entalpii, a potem bez skrępowania antropomorfizujesz walki; kiedy dostrzegasz drzazgę w oczach Zachodu, a nie dostrzegasz belki w oczach Wschodu, to ja nie bardzo wiem, jak z Tobą rozmawiać.
Dla ochrony życia część Słowian dała się ochrzcić pod krzyżackim butem … Tak sobie myślę prywatnie … pozostałych „chrzciciele” wyrżnęli z bogiem na ustach … takie Gott mit uns … !
@SŁOWIANIN STANISŁAW:
W praktyce rozważań o wojnie i wyższości śmierci nad wolnością lub odwrotnie, istotne jest, czy nasz system faworyzuje psychopatów stojących na czele państw, czy też zapewnia może sensowny balans między wartościami życia i wolności.
W przypadku wojny w Ukrainie akurat wszystko przemawia za obrońcami — atak był nieusprawiedliwiony, mają realną szansę na jego odparcie (bo dobrze się przygotowali), powstrzymanie się od walki byłoby zachętą do dalszej agresji i większej liczby ofiar. Dlatego bardzo mnie dziwi, że akurat teraz podnosi się takie argumenty, a nie np. omawiając wojnę obronną w 1939 (w obliczu przewagi Wehrmachtu o wiele mniej argumentów stało wówczas po stronie stawiania zbrojnego oporu), czy powstanie warszawskie (j.w., tylko bardziej).
***
Co do historii to nie wiem, o czym mówisz. Tacy połabscy Słowianie mieli zostać wyniszczeni ostatecznie dopiero przez wojnę trzydziestoletnią, ale nie szło o krzyżowców krzyczących Gott mit uns, ale o towarzyszące wojnie głód i zarazę. Cały czas wypomina się jeden przypadek wybicia słowiańskich przywódców koło X wieku, ale był to jeden przypadek i dotyczył tylko przywódców; bo zwykli ludzie byli wartościowymi poddanymi. To prędzej można o wybijanie Słowian posądzić już rodzimych Piastów, czy też Przemyślidów — w końcu to Praga była centrum handlu niewolnikami. Tyle, że cóż, Piastowie i Przemyślidzi byli Słowianami.
@ PAK4
1 CZERWCA 2022
10:34
Przeciez kalvaryja nie chce rozmawiac tylko „glosic”. Daleko mu jeszcze do decyzji Sary i Edwina. Ciekawe po co to skopiowal? Czyzby podswiadomosc mu cos podpowiadala?
Ponoć ZSRR był więzieniem narodów … Gorbaczow rozwiązując ZSRR nie zadbał o granice republik zgodne narodowościowym składem ludności … podobnie jak kolonizatorzy np. w Afryce … Tak sobie myślę prywatnie … banderowska Ukraina preferuje kraj dla swoich … i mamy co mamy … odbijamy Rosjan …
@mfizyk:
Myślę, że w miarę czuję osobowość kalvarii. I że nie tyle chodzi o „głoszenie”, co o krzewienie poczucia własnej wyjątkowości, przenikliwości — świat się myli, a ja mam rację. No dobrze: Zachód się myli, a ja mam rację. Ale, myślę że wyrażę nie tylko swoją myśl, jałowością wystawiania się na taką „wyjątkowość” można być, zwyczajnie zmęczonym.
@SŁOWIANIN STANISŁAW:
1) „Więzienie narodów” tym bardziej nie jest argumentem dla przemocy, niż byłoby nim odpieranie przemocy.
2) „odbijamy Rosjan” — 1 os. l. mn., to wyraz pragnień, czy poczucie przynależności?
3) Czasem sobie można poteoretyzować, czy nie lepiej byłoby rozwiązując ZSRR przeprowadzić serię referendów, do jakiego kraju chce się przynależeć; i co zrobić z tymi, którzy chcą do USA — ale to „teoretyzowanie”, na które nie ma miejsca 30 lat później, w obliczu zbrojnej agresji, która ów proces rozkładu próbuje odwrócić. Jest czas teoretyzowania i czas wstrzymania się od niego.
Czy jankesi przeprowadzili referendum : Do rezerwatu jakiego stanu chcesz trafić czerwony podludziu … Tak sobie myślę prywatnie … jankesi rozdają światowe karty tzw. demokracji … a skundlony świat boi się sankcji … i mamy co mamy .. je z ręki jankesów …
UE nałożyła na rok kolejny sankcje na Syrię.
Panoszą się w niej siły amerykańskie i tureckie.
Kradnąc ropę, zboże.
Zbrojąc i chroniąc rebeliantów stworzonych dla rozbicia Syrii i obalenia Assada.
Jakoś nie widzę gromkich głosów potepienia, sankcji…
To samo w Jemenie, Somali.
Bezprawne działania zbrojne mocarstw sasiednich i zamorskich, nie wzbudzają zainteresowania.
Cała para w gwizdek- czytaj Ukrainę.
Tamte śmierci sa mniej wazne?
W jakims stopniu moge zrozumiec mordy na tle religijnym, ideologicznym.
Mordów i eksterminacji dla zysku, poprawienia swego położenia geopolitycznego, usprawiedliwić się nie da.
A z tym mamy do czynienia od 1950 roku.
Ofiary ida w dziesiątki milionów.
A „cały cywilizowany swiat” nie reaguje.
Bo to on ZABIJA.
Większość konfliktów zbrojnych, przewrotów, smierci z powodu sankcji, inicjował zbiorowy Zachód, jakieś 12% populacji Ziemi.
Globalny bandytyzm i neokolonializm ma jakies usprawiedliwienie?
Cywilizacja zachodnia jest cyniczna, amoralna, psychopatyczna.
Kto powstrzyma psychopatów?
Pozostaje Rosja i Chiny.
Zajmie to ładnych kilkanaście lat.
Nadzieja dla większości krajów świata to wynik konfrontacji na Ukrainie.
Przegrana NATO to koniec zastraszania 88% populacji, tłamszenia jej rozwoju,
PAK4 1 czerwca 2022 10:34
Putina jeszcze na świecie nie było, kiedy „banderowskie rezuny Lachiw rezali” Wszystkich, którzy nie zdołali uciec i w wyjątkowo okrutny sposób – nawet syn matkę a ojciec swe córki , bo to tylko „Laszki były”. Wg ówczesnych zwyczajów w małżeństwach mieszanych syn dziedziczył narodowość ojca a córki matki.
Powiesz, że Polacy poniżali Ukraińców ale czy KAŻDY Polak to czynił ?
Ok. 100 lat wcześniej również polscy chłopi mordowali „panów” ( rzeź galicyjska ) ale oni mordowali tylko ZŁYCH panów – ziemian, zarządców, ekonomów , urzędników a nawet księży , którzy wszyscy traktowali ich jak bydło natomiast nie robili tego DOBRYM panom ani ich rodzinom ( żonom i dzieciom ) – nawet tych złych !
Bolszewicy popierali zwalczanie wg kryteriów klasowych a nie narodowościowych – „panów” ale prostych ludzi !
Widzisz różnicę ?
Można by o tym zapomnieć ( było , minęło ….) gdyby nie to, że obecnie „tamci” banderowcy są dla dzisiejszych Ukraińców ( mniej więcej dla ok 75% ) BOHATERAMI i WZOREM do naśladowania co widać, jak oni traktują u siebie Rosjan.
Jesienią ubiegłego roku czworo Polaków reprezentujących UMCS i Filharmonię Lubelską jadącą do Lwowa zatrzymali Ukraińcy – zdewastowali im samochód , pasażerów pobili – kierowcę do tego stopnia, że wylądował w szpitalu a policja ukraińska biernie się temu przyglądała interweniując dopiero, gdy realne stało się, że zostaną zamordowani.
Dziwisz się tym, którzy są sceptyczni wobec szczerości ukraińskich deklaracji ?
PAK4
1 CZERWCA 2022
12:33
Przestań…
„Więzienie Narodów ” to zgrabne anglosaskie hasełko, mające przykryć „dokonania”
Imperium nad którym nigdy nie zachodziło słońce.
Do dzis ma ponoć WIELKA Brytania kolonie i zamorskie terytoria zależne.
W których poziom zycia jest co prawda po wybiciu tubylców wysoki.
Małe populacje, duże zasoby naturalne, to klucz do sukcesu.
I oczywiście MEDIA….
Czystki etniczne i ludobójstwo to brytyjska koncepcja.
Przejęta przez Amerykanów, Belgów, Holendrów, Niemców.
Mozna byc biblioznawcą, poświęcić tysiące godzin na studiowanie zapisów.
A tymczasem rzeczywistość skrzeczy….
I trup ściele się gęsto na naszych oczach.
Ukraina jest od 2005 roku brytyjsko- amerykańską kolonią.
Z dużym udziałem Niemiec i Kanady, Francuzi i Izraelczycy też tam się kręcą.
Efekt widzimy.
Projekt czystek etnicznych na wzór Jugosławii czy Rwandy, Iraku, Syrii, napotkał sprzeciw, opór militarny.
Czystek etnicznych w Małorosji nie będzie.
@kaesjot:
Widzisz, byłem skłonny rozważać serio Chazarów, bo nie wiązałem sprawy z antysemityzmem. Cóż, miałem szczęście — poza licealnym polonistą (ale jakoś tam trzymającym fason), do pełnoletności nie spotykałem antysemitów.
Tak samo mam w gruncie rzeczy neutralny stosunek do Ukraińców, czy Rosjan i w sprzyjających czasach mógłbym sobie poteoretyzować o referendum dotyczącym przynależności państwowej w Donbasie. Tak, wiem, że był Wołyń, rzeź Pragi, czy Katyń, ale tak samo wiem, że była rzeź galicyjska, albo że Mieszko I handlował niewolnikami… Ot, historia, wniosek polityczny mam tylko jeden — nie wierzyć konserwatystom, którzy przeszłość idealizują.
Tu i teraz mamy autorytarną Rosję, która napada na plus-minus demokratyczną Ukrainę. „Napada” nie określa tu agresji słownej, ale najzupełniej dosłowną, pełnoskalową wojnę, która zawsze pociąga za sobą ofiary cywilne, przekreślanie dorobku zwykłych ludzi, straty ekologiczne… Innymi słowy: wojna jest zła i należy być przeciwko tym, którzy wojnę zaczynają. (I nie robię tu wyjątku dla Stanów, bynajmniej, więc wypraszam sobie na przyszłość takie argumenty.) Tę zaczęła Rosja. I to Rosja, w której zwykły Rosjanin ma niewiele do powiedzenia na temat polityki swojego kraju — tym bardziej obciąża to Władimira Władimirowicza.
@wiesiek59:
Moskiewska prasa marzyła o mieszkańcach Donbasu witających armię rosyjską z kwiatami. Biadała, że prorosyjska partyzantka nie może zaistnieć w Ukrainie.
Jeśli masz jakieś wątpliwości, czy zwykli obywatele Ukrainy czują się więźniami zachodniego kolonializmu i wyrywają się do objęć cara Putina, to pomyśl o tym, czego nie ma.
PS.
Poza tym, jak może zauważyłeś, nawet witanie z kwiatami, czy prorosyjska partyzantka, nie byłyby dla mnie argumentami dla poparcia zbrodni jaką jest rozpoczęcie agresywnej wojny.
PAK4
1 CZERWCA 2022
13:14
Zamach stanu finansowany z zewnątrz, nie jest powodem do wojny?
Próba pacyfikacji rosyjskojęzycznych, z tysiącami ofiar, również?
Taka politykę prowadzili wielopaszportowcy zainstalowani na Ukrainie po zamachu.
Odcięcie wody, prądu, zakaz używania języka, niewypłacanie emerytur, ostrzał artyleryjski, były słuszną metodą zdobywania serc i umysłów?
No to żyjemy w różnym świecie…..
Agresywne wojny zaś, produkuje tasmowo zachód, nie wschód.
Franciszek słusznie wspomniał, że NATO szczeka pod rosyjskimi drzwiami.
Niedługo odbędą się manewry morskie Quad, pod drzwiami chińskimi….
Po co?
By sprowokować do reakcji?
@ wiesiek59
1 CZERWCA 2022
13:45
Rozumie twoja frustracje. Bo tu mija twoje zycie a kapitalizm nadal sie rozwija, USA nadal mocarstwem, Afryka ucieka na zgnily Zachod … I tylko ZSRR padl a Rosja marnieje 🙁
Jak tu zyc, panie… 🙂
Sport i polityka
Odwoływano udział w igrzyskach olimpijskich, wykluczano drużyny i zawodników, zmieniano reguły, gdy napięcia polityczne tego wymagały.
W Wielkim Szlemie, którego kolejna edycja zbliża się Wimbledonie, zdobyte punkty nie będą uwzględniane w rankingu.
W kolejnym meczu ćwierćfinałowym na kortach w Paryżu zmierzą się Polka Iga Świątek z Amerykanką Jessie Pegulą. Amerykanka jest córką miliardera.
W USA jest wielu miliarderów i rzesza zwykłych milionerów. Z pewnością nie zależy im na zbawieniu świata i chcieliby utrzymać swoje interesy i pieniądze na wodzy. W tym nie pomoże im wojna światowa. Mają możliwości aby takiemu zderzeniu cywilizacji zapobiec. Oczekuję na te starania.
PS. W Polsce nie mamy miliarderów, w każdym razie na amerykańskim poziomie. Tu rządzi prezes.
Finał miał być w Sankt Petersburgu, ale zrobili sankcje na Rosję i sobie atrakcje:
” Przed stadionem dochodziło do dantejskich scen, policja gazowała często przypadkowych ludzi, chuligani forsowali wejścia bez biletów, kibice z biletami nie mogli dostać się na trybunę…Wielu kibiców angielskich było atakowanych przez miejscową „młodzież”, dochodziło do rozbojów i rabunków.
Kibice Liverpoolu twierdzili, że „burdy wszczynali młodzi ludzie mieszkający w pobliżu stadionu”, co potwierdzały liczne filmiki z zajść. Twierdzili również, że po meczu byli atakowani, a wielu padło ofiarą kradzieży. Znając reputację tych przedmieść Paryża, można im wierzyć. Zresztą Vincent Trémolet de Villers, zastępca redaktora naczelnego „Le Figaro” sam kpił z „orwellowskiej wizji” ministra Darmanina, który usprawiedliwiał chaos złą reputacją angielskich kibiców, bez których zapewne „miasto Saint-Denis byłoby oazą spokoju”.
Seine-Saint-Denis to najbardziej muzułmański i imigracyjny departament (93) Francji. Rozmaite incydenty, brak bezpieczeństwa, zamieszki są tutaj codziennością. Skutkiem wydarzeń podczas finału LM była jednak kompromitacja organizatorów i fatalny wizerunek Paryża. Rzecz jest poważna, bo Paryż za dwa lata będzie miastem-gospodarzem olimpiady letniej, a część konkurencji odbędzie się właśnie w Seine-Saint-Denis.
Le Pen mówiła nawet o „poczuciu upokorzenia”, które pozostawia po sobie organizacja finału LM. Dodała, że „sytuacja w Seine-Saint-Denis wymyka się spod kontroli”. Warto jednak dodać, że np. lewicowi publicyści w TV francuskiej natychmiast uznali takie rozpoznanie faktów za „rasistowskie”.
Inny polityk prawicy, Eric Zemmour, podsumował incydenty na Stade de France tezą, że „Seine-Saint-Denis stała się obcą enklawą”. Dodał na antenie Europe 1, że ten departament „od dawna nie jest Francją”. Zażartował nawet na Twitterze, że „dla bezpieczeństwa i ochrony wizerunku powinniśmy zbudować Stade de France we Francji”. Tu warto dodać, że budowa tego obiektu na MŚ właśnie w tym miejscu, miała zmieniać oblicze dzielnicy, ale eksperyment się raczej nie powiódł.
Dodał, że jest pełen goryczy, kiedy dawne „miasto królów staje się obcą enklawą, gdzie prawie nie mówi się już po francusku, gdzie ludzie nie są już ubrani po francusku, gdzie ich maniery też już nie są francuskie”.
Zresztą niektórzy politycy poszli jeszcze dalej. Polityk centroprawicowych Republikanów i były doradca prezydenta Sarkozyego, Henri Guaino reagując na incydenty pod Stade de France, stwierdził, że Francję może czekać… wojna domowa. „To, co przydarzało się w minionych pokoleniach, może się powtórzyć” – dodał Guaino w TV CNEWS w niedzielę 29 maja”
całość:
https://pch24.pl/miedzynarodowy-skandal-i-kleska-polityki-multi-kulti-to-pokazal-nam-final-ligi-mistrzow-w-paryzu/
============
Cosik nie wyszło…….
Z tymi koncepcjami multi- kulti…..
@wiesiek59:
> Zamach stanu finansowany z zewnątrz, nie jest powodem do wojny?
Widzisz, oświecasz mnie, że w lutym tego roku doszło do jakiegoś finansowanego z zewnątrz zamachu stanu w Ukrainie. Tylko jakim cudem ani premier, ani prezydent się nie zmienili?
A serio: ani nie było zamachu, ani nawet nie byłby to wystarczający powód do wojny, gdyby zamach się odbył.
> Próba pacyfikacji rosyjskojęzycznych, z tysiącami ofiar, również?
Masz jakieś źródła, które mówią, że siły ukraińskie chodzą, pytają soczewica, koło, miele młyn, czy co tam służy do odróżnienia rosyjskojęzycznego od ukraińskojęzycznego, a następnie go mordują?
Bo myślę, że przepijasz do wojny w Donbasie, a więc nie „pacyfikacji rosyjskojęzycznych” tylko wojny. I to wcale nie rozpoczętej przez Ukrainę, tak nieśmiało zauważę.
> Odcięcie wody, prądu
Donbas? Bo jeśli tak to mamy wojnę, patrz wyżej. Potępiam wojnę między innymi dlatego, że do tego prowadzi. Tylko znowu — pretensje proszę adresować na adres W.W.Putin, Kreml, Moskwa, Federacja Rosyjska.
> zakaz używania języka
Gdzie, kiedy, jak, skoro tylu obywateli Ukrainy mówi po rosyjsku?
> niewypłacanie emerytur
Mówiąc zupełnie serio, spotkałem tezę, że faktycznie idzie o pieniądze. Nie o emerytury, tylko podatki. Bo się jacyś donbascy oligarchowie opłacają i Moskwie i Kjowowi, a woleliby tylko jednej stronie. Albo, w optymalnym przypadku (dla nich) przedłużającej się wojny, nie płacić nikomu.
> ostrzał artyleryjski, były słuszną metodą zdobywania serc i umysłów?
Nosz, przecież pisze, że potępiam Putina i życzę mu z okazji dnia dziecka zamachowców z zabawkami. Cieszę się, że w końcu zacząłeś się ze mną zgadzać 😀
PAK4
1 CZERWCA 2022
14:22
Jak czytam, masz zerową wiedzę na temat kolejnych posunięc ukraińskiego rzadu, poczynając od Jaceniuka.
Wygooglaj sobie na poczatek ukraińska ustawę językowa.
Potem pójdzie jak z płatka, kolejne wymienione posunięcia.
Nie czytasz likowajych tekstów bo sa sprzeczne z twoim nastawieniem.
Najprecyzyjniej uszeregował te kwestie pułkownik Baud ze Szwajcarii.
Dostępne w necie.
Mogę dyskutować na tematy biblijne, czy historyczne, bo mam przynajmniej blade pojęcie.
Ty o polityce międzynarodowej nie masz żadnego, niestety.
Ekstrapolując nieco trend, przypuszczalnie na 90% etap trzeci specjalnej operacji debanderyzacji, demilitaryzacji, zmuszenia do neutralności, będzie w kolejności Odessa i Kijów.
Maja przewagę ludności rosyjsko- kulturowej i strategiczne znaczenie.
Rosjanom wbrew powielanych w naszych mediach bzdur ukraińskiego sztabu, nie kończy się amunicja, siła żywa, sprzęt.
Efekt?
Straty ukraińskie na poziomie do 500 ludzi dziennie.
Operacja Bagration angażowała tysiące czołgów, 11 000 dział, setki samolotów, milionowe armie.
Ta obecna angazuje 1/10 tego, z podobnym skutkiem.
Zajęto już 1/4 Ukrainy- 150 000 km/2.
Za pomocą minimalnych sił.
To prawie połowa Polski, jak by sie kto pytał…..
Maszynka do mielenia mięsa uruchomiona przez zachód działa.
Dla ZYSKU, nie w interesie tubylców.
Tematem sa „Więzi życia”.
Na pewno?
Życie podludzi nie ma znaczenia, skoro można na tym ZAROBIĆ.
Tak było w Afryce, Ameryce, Indochinach, Polinezji, Australii.
Dlaczego ten model miałby się nagle zmienić?
Coś przeskoczyło w stronę moralności w elitach?
Nie widze…..
@PAK4
Obejrzyj sobie na Google Earth zdjęcia przedmieść Doniecka. Widać tam ruiny domów mieszkalnych ( z góry powinno się widzieć dachy a są widoczne tylko zarysy murów. Na polach liczne leje po wybuchach i wyraźne linie okopów. Są to oczywiste ślady toczących się tam cięzkich walk. Na dole natomiast jest data wykonania zdjęć – 24 września 2019 czyli ok.2,5 roku przed tym, kiedy wojska rosyjskie wkroczyły na Ukrainę !
To kto z kim toczył te boje ?
@wiesiek59:
Po pierwsze i najważniejsze — nawet gdyby te argumenty o których piszesz były prawdziwe (a wiem, że przynajmniej w ogromnej części nie są), nie byłoby to usprawiedliwieniem dla agresji Rosji na Ukrainę. To nie ten kaliber zarzutów. Wyrzuć z głowy uprzedzenia wobec Zachodu i wiarę w spiski, a sam to powinieneś zobaczyć.
Po drugie, „do znalezienia w necie”… No przepraszam, ale taka PCh24 z ostatniego Twojego linka… To nie są fakty, to są śmieci. Robisz dokładnie to, co mi zarzucasz — wyszukujesz teksty, które są antyzachodnie, albo prorosyjskie i im wierzysz. Nawet ich nie analizujesz (patrz: po pierwsze i porównanie wagi zarzutów z uzasadnieniem wojny agresywnej).
Po trzecie, tam na serio giną ludzie. Traktujesz to wszystko wyraźnie, jako abstrakcyjne ćwiczenie z wylewania swoich fobii. Sorry, ale to nie jest gra komputerowa, symulacja, albo historia starożytna, gdzie kości pomordowanych dawno rozpadły się w proch i pył — to jest rzeczywisty świat, z rzeczywistymi ludzkimi tragediami.
Czytam sobie w antraktach trylogię – „Północ- Południe”.
Przecież jest to dokładna kopia tego co się działo w trakcie wojny secesyjnej i później.
Embargo na energię, nawozy, żywność, dla świata, spowoduje światowy głód, podporzadkowanie się polityczne tym, którzy będą w stanie dostarczyć rakujące wolumeny.
Tak załatwiono Indian, wybijając bizony , spychaąc na nieurodzajne ziemie, uzależniając od skąpych dostaw agencji rządowych.
Tyle że obecnie skala jest GLOBALNA.
Zagłodzenie Indian, czy zagłodzenie świata, to INTERES.
Na którym nieliczni zarobią, liczni umrą.
Na szczęście, kilka krajów jest w stanie się temu scenariuszowi przeciwstawić.
O dziwo, również Arabowie.
Na II WŚ najwięcej zarobili jankesi … Tak sobie myślę prywatnie … pecunia non olet … !
PAK4
1 CZERWCA 2022
15:24
Nie jesteś w stanie ocenić FAKTÓW.
Brak ci wiedzy.
Poszukaj sobie Bauda.
ie chce mi się po raz n-ty tłumaczyć kolejności zdarzeń.
Ty studiowałeś przez tysiąc godzin Biblie, ja geopolityke, wywiady z prominentnymi politykami, koncepcje opracowywane w różnych wpływowych think- tankach, przekładających się na decyzje polityczne.
Wypierasz, nie chcesz przyjąć do wiadomości konkretnych wypowiedzi, analiz.
Po prostu nie czytasz.
Wiesz, że człowiek w białym kapeluszu to dobry, w czarnym zły.
Imperium Dobra jest bez skazy.
Jak ma się do tego pozycja wasali Imperium?
Szczególnie tych mniej BIAŁYCH?
Media tworzą stereotypy, nieprzypadkowo a celowo.
Jesteś ich ofiarą, jak sadzę.
Wydarzenia w Donbasie i okolicy żywo przypominają israelskie przepędzanie obszczekujących Arabów … Tak sobie myślę prywatnie … dlaczego tzw. zachodnia cywilizacja nie zarzuca militarnego plagiatu … to jej wynalazek strzelać do wrogów jak do psów czy jak do kaczek …
@wiesiek59:
Wieśku, a nie zauważyłeś, że ja wcale nie jestem proamerykański, że nie popierałem inwazji na Irak, a nawet Afganistan? Nie mieści Ci się w głowie, że można mieć inne zdanie tylko dlatego, że waga faktów do tego prowadzi, a nie proamerykańskość?
***
> Rosjanom wbrew powielanych w naszych mediach bzdur ukraińskiego sztabu, nie kończy się amunicja, siła żywa, sprzęt.
Wiesz, mnie ta wojna o tyle dziwi, że Rosja nie tylko postąpiła amoralnie, ale i głupio, atakując w nieco ponad 200 tys. Ukrainę, która zmobilizowała do obrony 300 tys. I, powtórzę, żadnych tłumów z kwiatami witających wyzwolicieli nie było — ta uciskana mniejszość rosyjska, która pragnie wyzwolenia zwyczajnie nie istnieje. A chyba ktoś na Kremlu w nią uwierzył…
Ale wróćmy do tematu — Rosja zaatakowała nie przygotowując się dostatecznie. Najmądrzejsze byłoby wycofanie się z takiej wojny. Ale rozumiem Putina — wycofanie się to przyznanie do klęski, a to już zaproszenie do nowego 1905, czy 1917 roku. Rosja mogłaby wyjść z tego bardziej demokratyczna, ale on sam by z tego żywy nie wyszedł. Więc Rosja dosyła nowe oddziały, wyposażając je w sprzęt z demobilu.
Nie wiem, jak Ty, ale ja jak większość chłopców jako dzieciak zaczytywałem się w historiach o wojnie. I jedną z najgłupszych rzeczy, jakie przedstawiano, było stopniowe dorzucanie odwodów — wtedy silniejszy przeciwnik może je kolejno rozbijać i nigdy nie dadzą one strategicznej przewagi pozwalającej wygrać wojnę. To właśnie robi teraz Rosja — wysyła ludzi i sprzęt jako mięso armatnie, by nie mieć u siebie nowego roku 1905.
Jedyną nadzieją dla Rosji jest to, że Zachód się zmęczy, a pozbawiona pomocy Ukraina szybciej wyczerpie swoje zapasy. To jest wojna na wyniszczenie i wymęczenie przeciwnika, z całą swoją brzydotą. Zresztą, jeśli cytujecie prorosyjskich trolli, to znaczy, że dajecie się w nią wciągnąć. Bo zadaniem trolli jest osłabianie Zachodu, by ludzie narzekali i ograniczali pomoc. Będzie straszenie atomem, będą rozdmuchiwane problemy z kosztami paliwa, będzie przypominany Wołyń. Itp. itd…
@kaesjot:
Ależ ja wiem, że tam jest wojna od 2014.
Tylko jakoś dziwnym trafem dopiero co pouczaliście mnie, że zły Zachód zniszczył Jugosławię i bombardował Belgrad. A przecież to wszystko, co zarzucacie jako zło Zachodowi, robi — to przecież nawet w „argumentach” które mi przysyłacie widać, ja nie muszę czytać Guardiana, czy oglądać DW24 — teraz Rosja z Ukrainą. To co? To znaczy, że Polska popełniła grzech nie atakując Rosji, gdy ta pacyfikowała, mordując ludność cywilną, Czeczenię? W końcu, zgodnie z logiką, że za zniszczone domy w Donbasie odpowiada Ukraina i to usprawiedliwia napaść na nią, to za zniszczone domy w Czeczeni należało zaatakować Rosję; a za mordy w Bośni, 101 Dywizja USA powinna wylądować w Belgradzie i zmienić tam rząd.
Zmaganie się z tym brakiem logiki i konsekwencji, który tu wnosicie, przyprawić może o ból głowy.
PAK4 1 CZERWCA 2022 14:22
Znów tylko „cut and paste”?
PAK4 1 CZERWCA 2022 12:33
Już tu napisałem, że Świat to jest „cuś” znacznie większego niż tzw. Zachód. W zależnosci od definicji owego Zachodu, jest to około 900 milionów (11% ludności świata) i obejmuje to Unię Europejską, Amerykę Północną, Australię i Nową Zelandię. W najbardziej inkluzywnym podejściu (po dodaniu części Azji Wschodniej, Południowej Afryki i w zasadzie wszystkich krajów europejskich, które są częścią UE lub NATO), jest to około 1,2 miliarda, czyli około 15% ludności świata, która wynosi dziś około 8 miliardów. Tak więc to NIE świat się myli, ale tylko 10 do 15 jego procent, a więc to Ty, a nie ja żyjesz w tzw. „fool’s paradise”, gdyż Zachód to NIE jest cała ludność świata. Poza tym, to nawet na owym Zachodzie, to spora część ludności myśli tak jak ja, jak też jest to widać w tej dyskusji.
Program Ameryki nazywa się Full Spectrum Dominance.
Doktryna ta została wysunięta przez Pentagon pokolenie temu i jest głównym (choć często mu odmawianym) motorem zachowań Amerykanów.
Full Spectrum Dominance wzywa do amerykańskiej militarnej dominacji na lądzie, powietrzu, morzu, przestrzeni kosmicznej, a nawet cyberprzestrzeni.
Ta doktryna Full Spectrum Dominance powinna być połączona z Doktryną Wolfowitza, która twierdzi, że raison d’etre Ameryki jest zapobieganie powstaniu jakiegokolwiek kraju lub grupy krajów, które mogą rzucić wyzwanie amerykańskiej dominacji nad światem.
Wszystkie inne preteksty do amerykańskich zachowań – broń masowego rażenia, zwalczanie terroryzmu, obrona wolności, demokracja, prawa człowieka i porządek świata oparty na zasadach – są kłamstwami i są warte kupy bzdur.
PLAN STRATEGII USA WZYWA DO UBEZPIECZANIA BRAKU ROZWOJU RYWALI
https://www.nytimes.com/1992/03/08/world/us-strategy-plan-calls-for-insure-no-rivals-develop.html
Doktryna Wolfowitza: Dlaczego USA i Rosja nigdy nie spotkają się oko w oko
”https://qrius.com/wolfowitz-doctrine-us-russia/
Strategia Pentagonu na rzecz dominacji nad światem: dominacja w pełnym spektrum, od Azji po Afrykę
”https://cubasi.cu/en/specials/item/1132-the-pentagon-s-strategy-for-world-domination-full-spectrum-dominance -z-azji-do-afryka
=========
Czy wszystko jasne?
Plany Anglosasów są długoterminowe.
Jest w nich miejsce dla Polski.
Jako pionka poświęconego w Wielkiej Grze.
wiesiek59 1 CZERWCA 2022 14:19
Multi-kulti oparte jest na zasadzie divide at impera i służy do kontroli klas nieposiadających przez klasy posiadające.
mfizyk 1 CZERWCA 2022 14:06
Ty chyba nigdy nie byleś ostatnio w USA, skoro twierdzisz, że to państwo się rozwija. Afryka wchodzi zaś pod protekcję Chin a Rosja i Chiny rosną w siłę.
6:3, 6:2
Twarda, ale wygrana walka na korcie.
W półfinale Polka zagra z Rosjanką, a to łatwa przeszkoda nie będzie. Ten mecz już jutro.
Teraz dwa ćwierćfinały mężczyzn. Rosjanin zagra z Chorwatem, a Norweg z Duńczykiem.
To już pełny relaks
wiesiek59 1 CZERWCA 2022 16:13
T A K!
PAK4 1 CZERWCA 2022 13:14
Ukraińcy witali Wehrmacht i SS z kwiatami. Zresztą odpowiedział Ci już Wiesiek.
PAK4 1 CZERWCA 2022 13:10
Chazarowie nie byli i nie są semitami, a więc o jakim tu można mówić antysemityzmie?
Poza tym, to Ukraina sprowokowała akcję Rosji, chcąc wejść do NATO i UE i tym samym przesunąć granice de facto USA jeszcze bardziej na wschód.
kaesjot 1 CZERWCA 2022
wiesiek59 1 CZERWCA 2022 13:02 i 13:09
Racja!
O sile demokracji świadczy dobitnie ilość zamkniętego dostępu do mediów alternatywnych.
Czy to już nazizm?
Czy jedynie totalitaryzm w rozkwicie?
„Myslozbrodnią” jest niepodążanie za stadem?
wiesiek59 1 CZERWCA 2022 12:53
Ten cały zachodni, czyli „cywilizowany swiat” nie reaguje na zbrodnie NATO, bo to on ZABIJA. I racja – tzw. cywilizacja zachodnia jest cyniczna, amoralna, psychopatyczna, a więc nadzieją dla większości krajów i ludności świata jest pozytywny wynik konfrontacji na Ukrainie, gdyż przegrana NATO tamże oznaczać bedzie koniec zastraszania 88% populacji świaa, koniec tłamszenia jej rozwoju.
SŁOWIANIN STANISŁAW 1 CZERWCA 2022 12:44
Dobre pytanie!
mfizyk 1 CZERWCA 2022 11:51
Pozapominam Ci, że psychoanaliza jest szalbierstwem, podobnie jak pseudonaukowe teoryjki jej Ojca Wynalazcy.
„Polityka USA zawsze miała na celu uniemożliwienie bliższej współpracy Niemiec i Rosji”
Tło historyczne, polityczne i gospodarcze wojny ukraińskiej
Wywiad z Jacques Baud *
https://zeitgeschehen-im-fokus.ch/de/newspaper-ausgabe/nr-4-vom-15-maerz-2022.html#article_1306
Nieprzewidywalni i roszczeniowi
Większość ludzi chce spokojnie dokonać żywota.
Kiedyś zdumiała mnie informacja, że Amerykanie wbrew pozorom niewiele podróżują i prowadzą, statystycznie biorąc, osiadły styl życia.
W Polsce Ludowej nie mieliśmy większego wyboru, poza mniejszościami etnicznymi. Pozostawał ZSRR i państwa demokracji ludowej. Każdy mógł tam pojechać, jak chciał, ale trzeba było swoje odstać w kolejce do biura podróży.
Od trzydziestu lat obywatele mogą pojechać gdzie chcą i kiedy chcą, nikt ich nie ogranicza więc miliony podróżują.
Sytuacja na wschodzie spowodowała, że masowo podróżują sąsiedzi ze wschodu. Przyjmujemy ich gościnnie, chociaż końca nie widać.
Pod „Biedronką” zbierają datki. Działalność charytatywna nie jest zła, ale bez przesady.
W kraju mamy wielu ubogich. Dzisiaj słyszałem taką rozmowę „dla nich wszystko, a kiedy nami się zajmą?”
Trudno powiedzieć
???
PAK4 1 CZERWCA 2022 10:34
P-omijając twoją „blies-sed igno-ra0nce” w dzie0dzinie termo-dyn-amiki, to w os0tatnich 30 latach Ukra-ina była tak samo nie-podległa jak jako U S S R, czyli Ukra-inian So-vi-et So-ci0alist Re-pu-blic, tyle że, tak jak Polska, za-mieniła ona swego Pana z mos-kiewskiego na wa-szyngtoń-skiego, z tra-gicznym dla niej skutkami: http://www.academia.edu/57162621/A_note_on_the_economic_collapse_of_Ukraine_in_years_1990_2020.
PAK4 1 CZERWCA 2022 10:34
A swoją drogą, to kolonializm i imperializm „wschodni” jest dla mnie tak samo zły jak kolonializm i imperializm „zachodni”, gdyż i jeden i drugi oznaczał zawsze tragedię dla ludów podbitych, tyle że w przypadku Polski i Polaków, to największe szkody powodował u nas zawsze Zachód.
Poza tym, to zabito Kennedy’ego i nic to nie dało, nie zakończyło to pasma zbrodni US Army i Marines w Wietnamie.
Natomiast w przypadku wojny NA Ukrainie, to akurat wszystko przemawia tam za Rosją, gdyż jej atak był usprawiedliwiony a Ukraińcy czyli banderowcy NIE mają realnych szansę na jego odparcie, chyba że sprowokują III Wojnę Światową, po której nie tylko Ukrainy już nie będzie.
@Herstoryk
Dziękuję za podanie bardzo ciekawego artykułu.
…z upadkiem tytularnego już wtedy ale jednak wciąż symbolicznie ważnego kalifatu bagdadzkiego Abbasydów islamskim elitom zawalił się ideowo i politycznie świat. Od czego niektórzy głośni i wpływowi dostali ideowego kręćka i „odnaleźli (fundamentalistyczną) religię”. Co w połączeniu z utratą ksiąg mogło przyczynić się do tego zastoju.
Jeżeli najazd Mongołów na kalifat bagdadzki był przyczyną odwrócenia się muzułmanów od nauki i zamknięcia się w fundamentaliźmie religijnym, to rzeczywiście zniszczenie biblioteki bagdadzkiej można uznać za katastrofę większą niż zniszczenie biblioteki aleksandryjskiej a może nawet największą ogólnie w historii – zważywszy na skutki tego dzisiaj. Załączony artykuł wchodzi głębiej w temat w poszukiwaniu przyczyn wewnątrz samego islamu – religii i związanego z nią ustroju politycznego – ale mogę sobie wyobrazić, że taki wstrząs, jakim był najazd Mongołów, stał się punktem zwrotnym w historii tej kultury. Jako historyk móglbyś napewno podać inne przykłady takich wydarzeń.
Kiedy brakuje mu argumentów albo kontrargumentów @wiesiek59 nieodmiennie zarzuca oponentowi brak wiedzy i zachwala swoje niezwykłe oczytanie i rozeznanie w temacie. Jak z takim dyskutować?
Redes22 1 CZERWCA 2022 17:05
A ty masz tylko pseudoargumenty typu ad personam. 🙁
Redes22 1 CZERWCA 2022 17:05
Not alwys, but too frequently…
Spelling mistakes are to mislead the c e n s o r s h i p.
Woda na Krym lepsza od potopu szwedzkiego … Tak sobie myślę prywatnie … będzie więcej żywność … takie sobie bronią i żywią …
@wiesiek59:
W ramach porowerowej refleksji, muszę powiedzieć, że zadziwia mnie, co piszecie.
Rosja postępuje tak, jak oskarża o postępowanie Zachód. I jak robi to Zachód, to potępiacie. Ale jak Rosja, to uważacie, że tak być powinno.
To jak z pisowcami. „PO kradła, to było złe. My też kradniemy, jak PO, więc jest dobrze”.
Mam z tym trzy problemy.
Problem pierwszy, to brak przechodniości, czyli hipokryzja, albo inny kalizm. Bo jeśli X robiąc Z robi źle; to Y robiąc Z też robi źle. Jeśli interwencję USA w Iraku uważam za nieusprawiedliwioną, to interwencję Rosji w Ukrainie uważam też za nieusprawiedliwioną.
Problem drugi jest brak prawdziwej symetrii, bo po jednej stronie mamy „oskarżenie”, a po drugiej mamy „czyny”. Oderwanie Kosowa mógł wspierać Zachód. Oderwanie Donbasu i Krymu wspiera Rosja. Oskarżenie nie musi odpowiadać faktom, w rzeczywistości w stosunku do wielu zarzutów jakie robicie Zachodowi (albo pisowcy robią PO) mógłbym polemizować, że to wcale nie tak, albo że działanie (Zachodu/PO) nie było na tę skalę i zakres.
Problem trzeci jest wyłączenie środka. Otóż za każdym razem pisowiec, gdy skrytykuje PiS, wyskoczy, że Tusk, że PO; albo Wy tutaj — że USA, Imperium. Przecież brak przynależności do jednej strony nie oznacza przynależności do drugiej. Ja mogę jednocześnie krytykować USA i Rosję; albo jednocześnie dystansować się od PO i PiS krzycząc viva Zandberg! I, jakby to powiedzieć, wcale nie przekonujecie mnie wtedy — raczej wywołujecie głęboki, wredny rechot.
SŁOWIANIN STANISŁAW 1 CZERWCA 2022 17:51
A po co nam ludziom więcej żywności? I tak już Nasza Planeta jest mocno przeludniona, a więc potrzebujemy mniej a nie więcej żywności – dla Jej i Naszego dobra! A dla adwersarzy- ja się wyżywię sam, z mojej przydomowej działki. Dlaczego mam się więc martwić na przykład o takich durnych Egipcjan, którzy żyjąc na pustyni, mnożą sie na potęgę, tak jakby mieli oni do dyspozycji nieskończony areał ziemi uprawnej i nieskończoną ilość darmowej wody do dyspozycji?
PAK4 1 CZERWCA 2022 18:16
1. Kto Ci płaci i ile za tę proreżimową, prozachodnią propagandę? CIA czy Mossad?
2. Przecież oderwanie Kosowa od Serbii wspierał Zachód a Donbas i Krym są etnicznie rosyjskie, a nie ukraińskie.
3. Ty krytykujesz tylko Rosję, a nie widzisz grzechów Zachodu, bo Ci za to płacą, tak jak np. Miłoszowi czy Giedroyciowi płaciło CIA.
4. Zandberg jest zaś lewakiem i też jest na żołdzie CIA, tak inni lewacy, aby skompromitować idee prawdziwej, marksistowskiej lewicy, dbającej o dobro ludzi pracy, a nie jak Zandberg o interesy garstki zboczeńców seksualnych.
PAK4 1 CZERWCA 2022 18:16
Poznasz głupiego po śmiechu jego.
PAK4
1 CZERWCA 2022
18:16
To kwestia SKALI niegodziwości.
I długości jej trwania.
Oraz stopień hipokryzji w redagowaniu historii świata.
Palestyna czy Syria codziennie sa ostrzeliwane, i musza to znosić.
Iran codziennie znosi zabójstwa swych prominentnych wojskowych i polityków.
Rosja nie musi, może odpowiedzieć siłą na agresywne zachowania sąsiadów, bądź stron trzecich.
Winą jątrzenia, obarczam WYŁĄCZNIE Zachód.
Ty widzsz jedno drzewo- Ukrainę.
Ja las składający się z kilkuset aktów agresji po 1945 roku.
Przeczytałeś linkowane teksty?
Dały coś do myslenia?
Prawo narodów do samostanowienia zawarte w Karcie ONZ jest martwe.
O ile nie otrzyma wsparcia.
Integralność terytorialna również jest chybotliwą konstrukcją.
Pozostaje argument siły, naduzywany przez kolektywny zachód.
Pieniądze, propaganda, moga zmienić prawie każdy rzad.
Ale, to działa w dwie strony.
Chiny czy Rosja musza się tego dopiero NAUCZYĆ.
Od zachodnich mistrzów….
kalvarya01
1 CZERWCA 2022
18:35
Zandberg jest dobrym człowiekiem, wychowanym w Danii.
Ale, wyżej d… nie podskoczy.
Medialne posokowce by go zniszczyły wraz z partią.
Musi bardzo ostroznie odbudowywać lewicę.
Bo stado baranów nie jest w stanie zrozumieć że walczy o ich przyszłość.
Lewice zniszczono w całej Europie, podmieniając na co?
Interesy 1% ?
Bezmyslny tłum głosuje na swoich panów feudalnych, i to do niego kompletnie nie dociera.
wiesiek59 1 CZERWCA 2022 18:56
Zandberg jest implantem z Zachodu, skierowanym do Polski, aby skompromitować do końca idee lewicowe dla większości Polaków. Przecież on popiera banderowców w ich walce z Rosją.
Ale zgoda co do reszty.
https://www.youtube.com/watch?v=dLxr0v-k0-E
========
Wracam do perypetii Chana Berke i Księcia Jarosława……
PAK4 popełnia tzw. błąd złożenia (fallacy od composition), czyli błąd logiczny polegający na przypisaniu całości cech niektórych elementów, z których się ona składa, a więc przypisuje on większości ludzi na świecie swoje, czyli zachodnie poglądy, wyznawane przez mniej niż 1/5 ludności świata, ale uważa się on za mędrka, co to zjadł niemalże wszystkie rozumy – tak jak Tusk, Duda, Wałęsa, Balcerowicz, Morawiecki, Kaczyński etc., etc.
kalvarya01
1 CZERWCA 2022
19:03
Kraje wasalne mają pełno takich „implantów”.
Na tym polega zarządzanie koloniami.
Obecnie jedynymi samodzielnymi politykami w Europie wydają się być Melanchton, Orban, Erdogan.
Reszta to marionetki, ze szczególnym uwzględnieniem „Zielonych” w Niemczech czy Skandynawii.
Podejmowane decyzje samobójcze gospodarczo.
Wiesiek – YouTube (poza jego częścią artystyczną, filmowo-muzyczną) jest dla ubogich duchem, dla analfabetów etc.
wiesiek59 1 CZERWCA 2022 19:11
Pełna zgoda.
Objawy zombozy z powikłaniami:
1. Upierdliwe twierdzenie ze w kapitalizmie jest wyzysk człowieka przez człowieka i koniecznie należy doprowadzić do systemu sprawiedliwego, gdzie będzie dokładne odwrócenie rol. Tak jak było w komunie.
2. Przekonanie, ze w społeczeństwie sprawiedliwym musi być specjalizacja. Jedni maja czytać, drudzy pisać a elita pilnować tychże intelektualistów.
3. Umożliwienie obrony stronie zaatakowanej jest amoralne.
4. Itd. …
R.S. 1 CZERWCA 2022 19:33
To skąd się bierze zysk kapitalisty, jak nie z pracy wyzyskiwanych przez niego pracowników? Z niczego? Ex nihilo? To dlaczego zatrudnia on owych pracowników i płaci im pensje? Z dobroci swego serca?
Poza tym, to tzw. komuna, czyli tzw. PRL, to był kapitalizm państwowy, gdzie rolę prywatnego kapitalisty odgrywali wysocy funkcjonariusze PZPR, czyli rządzącej monopartii. Podobnie jak dziś w USA, gdzie rządzą kapitaliści, kryjący się pod „sztandarami” tzw. demokratów i tzw. republikanów.
R.S. 1 CZERWCA 2022 19:33
Ad punkt 3 – To dlaczego Gospodarze tego blogu ciągle grożą mi banem?
kalvarya01
1 CZERWCA 2022
19:14
Kazachskie aktorki są PIĘKNE……
No a poza tym, Berke był sprawcą ekspansji Mongołów, również na Polskę.
Nie wiadomo, co by się działo, gdyby nie umarł w stosownym dla nas momencie.
Często życie i smierć jednego człowieka determinuje przyszłość milionów.
Lubię orientalne seriale historyczne, produkowane przez ich kinematografię.
Inne spojrzenie na historię śwata.
Alternatywną w stosunku do europejskiej.
R.S.
1 CZERWCA 2022
19:33
Jak by to delikatnie powiedzieć?
G…wiesz o założeniach socjalizmu, komunizmu, sprawiedliwości społecznej.
Koncentracja władzy w rękach nielicznych, to bieda dla całe reszty.
Która mają zreszta w głębokim poważaniu.
To przypadłość elit która jest UNIWERSALNA.
Dla jednych pałace, dla reszty slumsy, to nie jest model do nasladowania.
Masz jakąś koncepcję rozwiazania problemu?
@ PAK4
1 CZERWCA 2022
18:16
Pieknie celna analiza.
Tyle tylko, ze wiesiek (i jemu podobni) NIGDY nie moga sie z nia zgodzic. Bo straciliby sens zycia 🙁
mfizyk 1 CZERWCA 2022 20:27
Analiza na poziomie niedorozwiniętego siedmiolatka, czyli na twoim. I kup sobie wreszcie polskie czcionki, bo te, których używasz, to demaskują twoją lokalizację, jako centralę CIA, gdzie cięcia budżetowe nie pozwalają na zakup takowych czcionek.
wiesiek59 1 CZERWCA 2022 20:24
Racja!
wiesiek59 1 CZERWCA 2022 20:24
Nie oczekuj za dużo od „tytanów” intelektu typu malutkiego fizyczka, R.S. czy też alter ego tegoż drugiego, czyli PAK4. To jest tak, jakby oczekiwać rozbłysków inteligencji u Dezertera i innych jehowitów.
… należy pamietac, ze
5. Zomboza jest nieuleczalna
6. Zomboza virtualna jest śmiertelna dla medium w którym się rozprzestrzenia
7. Zomboza-22 została zmodyfikowana w Chinach z pomocą koncernów amerykańskich w celu osiągniecia wielkich zysków.
8. Szczepionki na zomboze sa dostępne tylko w USA
9. Najlepsza metoda to izolacja zombi, ale niestety zomboza mutuje i zmienia postać
10. Ogólnie nie należy przejmować się małymi procentami osobników które zapadły na te chorobę
11. Za wszelką cenę nie można wdawać się w dyskusje, bowiem zomboza przenosi się metodą kropelkowa a zombi pluja.
12. Prośby aby zombi założyly maseczki nie skutkują.
Inne znane przypadki zombozy nieco łagodniejsze
to
zomboza z odchyleniami sportowymi,
zomboza Penrosa,
zomboza słowiańska.
Być może dr Nowak zna lekarstwo, ale ani immodium ani invermectin nie działają.
R.S. 1 CZERWCA 2022 21:10
Ależ ty jesteś głupi… 🙁 Zrozum wreszcie, że tzw. Zachód, to jest mniej niż 1/5 ludności Ziemi i że nawet na owym Zachodzie, to ludzie mają bardzo często inne opinie niż te twoje, czyli obecnie tamże uważane za politycznie poprawne.
Dobrze zarobione pieniądze
„Oni grają mniej więcej o 600 tysięcy euro” powiedział sprawozdawca sportowy w czasie relacji tenisowego meczu pomiędzy Norwegiem a Duńczykiem odbywającym się aktualnie na korcie Roland Garros.
To ćwierćfinał.
Im wyżej w drabince tym więcej pieniędzy i nie są to jakieś drobne
„(…)Osioł skręcał właśnie przy rogu chodnika, kiedy przystojny
elegant, urękawiczony, ulakierzony, okrutnie ukrawacony
i uwięziony w nowiutkim odzieniu, złożył pokornemu
bydlęciu ceremonialny ukłon i rzekł, uchylając cylindra:
„Szczęścia pomyślności w Nowym Roku!”.
Po czym z chełpliwą miną odwrócił się do niewidocznych
towarzyszy, jakby w oczekiwaniu aprobaty dla swego
zadowolenia.”
źródło: Paryski splin – Charles Baudelaire
…oczekiwanie aprobaty…
arkusz papieru śniadaniowego
na zimnym szkle
daremnie opierającym
tarciom kąskiem węgla…
choćbyś i go darł
nie zaklaszcze
nie mrugnie z zachwytu
@kalvarya looknij za bark prawy, lewy
kibicujących zań nie ma
jeśli nawet coś trzepocze…
to pewnie zwykły przeciąg
rozkołysał auriculę i łomocze
o skórę głowy…
(na nic zarzekanie, jak trza to trza, siem odezwać!)
https://www.youtube.com/watch?v=jhdFe3evXpk
@Bohatyrowiczowa
Ładnie dobrałaś cytat. Wyrazy uznania.
Dla jednych pałace, dla reszty slumsy, to nie jest model do nasladowania.
@wieśku59 czy ty mieszkasz w slumsie?
Tymczasem w Turcji będzie dobra, bo NATO-wska wojna:
„Turcja rozpoczyna inwazję w Syrii. Erdogan wymienił cele operacji wojskowej”
IAR, oprac. Joanna Zajchowska, Wyborcza 01.06.2022 21:52
Prezydent Turcji zapowiedział, że Tal Rifaat i Manbidż w Syrii będą celami operacji wojskowej jego armii. Recept Erdogan przed parlamentem mówił, że chce oczyścić te tereny z terrorystów.
Decyzję o planowanej inwazji prezydent Erdogan ogłosił przed tygodniem. W środę w parlamencie mówił, że jej celem będzie utworzenie „bezpiecznej strefy” 30 kilometrów w głąb Syrii.
- Oczyścimy Tal Rifaat i Manbidż z terrorystów, a stopniowo będziemy robili to samo w innych regionach – mówił turecki przywódca. Obie miejscowości są kontrolowane przez kurdyjskie bojówki.
Nadal prowadzimy przez naszych partnerów skuteczną walkę z rozbitym ISIS w Syrii i nie chcemy, by cokolwiek mogło zaburzyć podejmowane przez nas wysiłki – oświadczył Waszyngton.
Ogłoszenie przez Ankarę nowej ofensywy w Syrii zbiega się z jej sprzeciwem wobec planów wstąpienia do NATO Finlandii i Szwecji.
Komentarze (nie moje):
- Widzę że we współczesnym świecie, tak jak wszyscy marzyli, wojny są w zaniku. Szerzą się za to operacje wojskowe w celach denazyfikacji i deterroryzacji.
- To jednak można napadać innych i pacyfikować? Co na to NATO?
- Spoko, Kurdowie nie mają takiego PR jak Upaina. Chyba, że wynajmą jakąś agencję.
Redes22 2 CZERWCA 2022 1:45
Od kogo ukradłeś pieniądze, za które kupiłeś albo wybudowałeś pałac, w którym mieszkasz? Czy też może masz te pieniądze z handlu narkotykami, żywym towarem i z prania brudnych pieniędzy?
ls42 1 CZERWCA 2022 21:52
Naprawdę nie wiesz, że tenis, tak jak piłka nożna czy golf (uprawiane „wyczynowo”, czyli zawodowo) to są pralnie brudnych pieniędzy? Skąd inaczej wzięłyby się te ogromne pieniądze, które są formalnie wypłacane zawodnikom czyli grajkom, aby stały się one czyste i mogły być puszczone poprzez owych grajków czyli słupów w legalny obieg?
Bohatyrowiczowa 2 CZERWCA 2022 0:20
Co na to twój psychiatra? A może jednak powinnaś go zmienić? Co Ci mówi na ten temat Telewizor (nie ludzie tam się pokazujący, ale Telewizor „jako taki”, czyli nawet bez podłączonej anteny czy kabla z „kablówki” i nawet kiedy jest on odłączony od zasilania)? I dlaczego wszyscy mówią o Tobie, kiedy tylko pojawisz się wśród innych ludzi? I jakie znaki dają ci potajemnie reptylianie przebrani za ludzi? Masz może widzenia Jezusa albo Jego Matki? A może przynajmniej jakaś Święta czy Błogosławiona Ci się pokazuje, np. Maria Franciszka Kozłowska, nazywana Mateczką?
R.S. 1 CZERWCA 2022 21:10
A co na to twój psychiatra? A może jednak powinieneś go zmienić? Co Ci mówi na ten temat Telewizor (nie ludzie tam się pokazujący, ale Telewizor „jako taki”, czyli nawet bez podłączonej anteny czy kabla z „kablówki” i nawet kiedy jest on odłączony od zasilania)? I dlaczego wszyscy mówią o Tobie, kiedy tylko pojawisz się wśród innych ludzi? I jakie znaki dają ci potajemnie reptylianie przebrani za ludzi? Masz może widzenia Jezusa albo Jego Matki? A może przynajmniej jakiś Święty czy Błogosławiony Ci się pokazuje, np. patron księży-pedofilów (ten z Wadowic)?
Redes22
2 CZERWCA 2022
1:45
Zwiedź slumsy Rio czy Mombasy.
Zamelduj, jezeli powrócisz żywy.
Polska nie ma slumsów, JESZCZE….
Ale, importujemy z zachodu wiele rozwiązań.
Na prrzykład, pół miliona bezdomnych się przydaje.
IPN sugeruje zombozę israelską z pejsami … Tak sobie myślę prywatnie jaką korzyść ma świat z istnienia stalinowskiego Israela … desant syjonistów z ZSRR …
kalvarya01 2 CZERWCA 2022 6:10 c.d.
- Turkom wolno napaść na Syrię. UE, USA i ONZ nie ma nic przeciwko temu. Hipokrytka Ursula von der Leyen nie ogłosi sankcji, bo inne są standardy dla zbrodniarza Putina, a inne dla zbrodniarza Erdogana.
- Rok 2029 – armia postępowej UE rozpoczyna operacje wyzwalania Polski z rąk heterofaszystów…;)
- Czy USA i UE potępią na skalę światową inwazję Turcji na Syrię i nałożą sankcje nr 1 na Turcję i Erdogana?
wiesiek59 2 CZERWCA 2022 7:02
Otóż to!
wiesiek59 2 CZERWCA 2022 7:02
W roku 1989 zaczęliśmy import bezrobocia, bezdomności, narkomanii i graffiti a teraz importujemy sobie znów, jak przed wojną, problemy z imigrantami i zboczeńcami seksualnymi. Tych ostatnich, to sprowadził zresztą do Polski ponad tysiąc lat temu niejaki Mieszko nr 1, niech mu smoła piekielna gorącą będzie.
Bohatyrowiczowa
31 MAJA 2022
0:21
Świetnie, że przypominasz A. Kępińskiego. To wybitny psychiatra. Szkoda, że zmarł tak młodo.
Twierdził, że wszystko co w życiu ważne zaczyna się od zabawy.
Twórca psychologii pozytywnej M. Seligman uważa, że są trzy filary zdrowia psychicznego: miłość, praca, zabawa.
A Kaczyński chciał mieć Stambuł w Warszawie … Tak sobie myślę prywatnie … teraz szykują majdan na Kremlu … Putin musi odejść … z tryzuba pomocą …
Jagoda 2 CZERWCA 2022 7:48
Prof. Kępiński był niewątpliwie wybitnym popularyzatorem psychologii i humanistą, ale nie był on psychiatrą ani naukowcem. On przecież nie miał nawet najmniejszego pojęcia o etiologii schizofrenii, etiologii pogranicznego zaburzenia osobowości etc. Psychiatria w jego wykonaniu była więc bardziej astrologią niż astronomią, alchemią niż chemią, metafizyką niż fizyką, etc. etc. I tak jest zresztą do dziś. Programista, wiedzący o komputerze tyle, co nawet najwybitniejszy profesor psychiatrii wie dziś o ludzkim mózgu, nigdy by przecież nie napisał programu, który by miał jakikolwiek praktyczne zastosowanie, poza pokazywaniem tego programu studentom, w ramach zajęć na temat „jak nie należy programować”.
Jagoda 2 CZERWCA 2022 7:48
Meinen Sie „Arbeit macht Frei”?
SŁOWIANIN STANISŁAW 2 CZERWCA 2022 7:57
Raczej to Biden musi odejść ze swoimi przydupasami.
Biden sends old, outdated weapons to Ukraine, but it can and with WWIII. The only way is to remove him and his men and women from power, but it can be done only by brute force. Maybe some generals or admirals will try to save themselves and the US and remove him from power? The same way as General Jaruzelski prevented WWIII in 1981?
Ukraińskie straty na wschodzie rosną
Rosyjskie wojska zbliżyły się do przejęcia kontroli nad centrum Siewierodoniecka, ostatniego dużego miasta we wschodniej prowincji Ługańsk, które wciąż pozostaje w rękach ukraińskich.
Miejscowy urzędnik powiedział, że siły rosyjskie zajmują około 70% miasta, ale walki trwają nadal. W Siewierodoniecku, gdzie kiedyś mieszkało ok. 100 tys. ludzi, pozostało tylko ok. 12 tys. mieszkańców.
W tym tygodniu prezydent Wołodymyr Zieleński powiedział, że każdego dnia umiera od 60 do 100 ukraińskich żołnierzy, a kolejnych 500 jest rannych w walkach. Ponieważ zarówno żołnierze, jak i cywile tracą kończyny w wyniku rosyjskich ataków, Ukraina rozwija przemysł protetyczny. Krok po kroku ukraińska armia wycofuje się z niektórych od dawna zajmowanych terenów w Donbasie, wschodnim regionie, który jest obecnie epicentrum wojny.
Broń: USA wyślą Ukrainie potężne systemy rakietowe, które znacznie zwiększą jej zasięg, pod warunkiem, że Ukraina nie będzie ich używać przeciwko celom na terytorium Rosji. Niemcy, przezwyciężając niechęć, obiecały Ukrainie zaawansowany system obrony przeciwlotniczej i radar śledzący, który pozwoli zlokalizować rosyjską ciężką artylerię.
Pomoc: Unia Europejska odmroziła 36 miliardów euro – około 38 miliardów dolarów – przeznaczonych na pomoc w walce z koronawirusem w Polsce. Unia Europejska zablokowała wypłatę pomocy z powodu pytań o niezależność polskich sądów, ale przychyliła się do tego po tym, jak Polska zajęła zdecydowane stanowisko przeciwko inwazji na Ukrainę.
The New York Times
Przetłumaczono z http://www.DeepL.com/Translator (wersja darmowa)
Przetłumaczone na polski przez https://www.deepl.com/translator
Jorge Vilches – autor tego artykułu 2 czerwca 2022 · o 1:31 EST/EDT
Proszę pomóż mi rozwiązać tę zagadkę.
Około 50% całkowitego światowego importu ropy naftowej pochodzi z Japonii + Korei Południowej + Australii + Nowej Zelandii + Kanady + USA + Europy. Podobno żaden z nich nie będzie teraz kupował ropy z Rosji, więc będą musieli kupować nierosyjską ropę od kogoś innego. W przypadku Europy 36% ich importu ropy jest teraz zmuszone zastąpić. Oczywiście OGROMNA ilość i to nie byle jaki olejek. Na przykład olej z Wenezueli nie nadawałby się do tego celu.
Które kraje eksportujące ropę zastąpią teraz brakującą rosyjską ropę dla tych „nieprzyjaznych” do kupienia?
Na przykład, czy będą miały odpowiednią jakość i wystarczającą ilość, aby zastąpić poprzedni eksport rosyjskiej ropy do Europy? Czy byłaby to Arabia Saudyjska? Irak ? ZEA ? Kuwejt ? Nigeria ? Kazachstan ? Norwegia ? Angola ? Brazylia ? Oman ? Meksyk ?
Aby zastąpić rosyjską ropę, te kraje eksportujące ropę będą musiały albo (a) nagle zwiększyć produkcję (?) i jak to dokładnie zrobią (??) … lub (b) zignorować swoich tradycyjnych klientów … i nagle odetnij je wysoko i wysusz i wyjdź na sprzedaż do Europy. W takim razie, gdzie ich tradycyjni klienci znaleźliby eksportera, od którego kupiłby olej o odpowiedniej jakości?
https://thesaker.is/europe-now-cheats-or-suffers/#comments
=========
Paliwa są krwią w krwioobiegu gospodarczym…..
Leczenie poprzez upuszczanie krwi pacjentom, oferowane przez polityków, to powrót do średniowiecznych metod leczenia.
Kaczyński miał w Kijowie szczęście nie dostał banderowskiego odznaczenia … Tak sobie myślę prywatnie … mądrze wybrnęli …
Order drugiej klasy … Tak sobie myślę prywatnie … to jak drugij sort …
wiesiek59 2 CZERWCA 2022 8:27
To jest proste jak budowa cepa – Arabia Saudyjska, Katar, Emiraty etc. będą kupować ropę naftową i gaz w Rosji i sprzedawać je jako swój własny produkt Polsce, Niemcom, Japonii etc., po doliczeniu odpowiedniej marży.
SŁOWIANIN STANISŁAW 2 CZERWCA 2022 8:28
On je przyjął, ale w tajemnicy przed Polakami,
Europa traci znaczenie na rzecz Azji … Tak sobie myślę prywatnie … Skansen Europa … wyprawy po złote runo na Wschodzie jak wyprawy krzyżowe … pachną Stalingradem …
@kalvarya01:
> 1. Kto Ci płaci i ile za tę proreżimową, prozachodnią propagandę? CIA czy Mossad?
Wysyłam te faktury do Sorosa i nic 🙁 A inflacja nie odpuszcza…
A tak serio, to czasem wiem, kto płaci za to, co czytam. Np. skąd się biorą finanse Guardiana.
A tu czasem widzę, jak się powołuje na źródła opłacane przez Kreml…
> 2. Przecież oderwanie Kosowa od Serbii wspierał Zachód a Donbas i Krym są etnicznie rosyjskie, a nie ukraińskie.
Kosowo było „etnicznie” albańskie, a za jego serbskością przemawiały argumenty prawne. Mamy tu więc bardzo dobrą analogię, z wyjątkiem tego, że kosowscy Albańczycy autentycznie buntowali się przeciwko rządowi w Belgradzie; podczas gdy bunt Donbasu był odgórnie sterowany. Problemy Jugosławii z Kosowem były już wyraźne w latach 80-tych, czyli na długo przed rozpadem, a tym bardziej przed uznaniem go przez Zachód.
Swoją drogą, Rosja uznała „niezależność” Krymu po ok. tygodniu od własnej inwazji w 2014 roku; a potem przyjęła go na swoje łono.
Tymczasem ten „żądny rozpadu Jugosławii” Zachód uznał secesję Słowenii po ponad roku od referendum i obronionej w wojnie domowej niepodległości; a secesję Chorwacji po ponad pół roku.
Tak, że ten tego, z faktami jesteś Pan na bakier.
> 3. Ty krytykujesz tylko Rosję, a nie widzisz grzechów Zachodu
Ależ widzę grzechy Zachodu. Staram się tylko przykładać tę samą miarę, i cóż, Rosja nawet we własnej propagandzie wypada równie źle jak Zachód w swoim najbardziej bandyckim wydaniu. A jeśli wziąć poprawkę, że to propaganda Kremla, to wypada gorzej.
> 4. Zandberg jest zaś lewakiem
Ależ ja też jestem przeciwko i Leninowi, i Korwinowi, i Kaczyńskiemu, i Putinowi. Ergo: jestem lewakiem.
> PAK4 popełnia tzw. błąd złożenia (fallacy od composition), czyli błąd logiczny polegający na przypisaniu całości cech niektórych elementów, z których się ona składa, a więc przypisuje on większości ludzi na świecie swoje, czyli zachodnie poglądy, wyznawane przez mniej niż 1/5 ludności świata
No właśnie mam wrażenie, że to Was dotyczy. Bo wciąż na uwagę, że Rosja postępuje obiektywnie źle, odpowiadacie, że Zachód jest „be”; jak ci pisowcy zmieniają temat na grzechy PO. To jest logika dwubiegunowego świata, gdzie nasz wybór ogranicza się do opcji A (Zachód/PO) lub B (Rosja/PiS). OK, ja wiem, że jesteś ode mnie o pokolenie starszy, ale mimo wszystko też powinieneś zauważyć, że zimna wojna skończyła się ponad 30 lat temu. Zresztą nawet, gdy trwała, to istniał ruch państw niezaangażowanych, więc to nie było tak proste myślenie binarne: my albo oni. Jesteś jak taki wyobrażony, liberalny odbiorca GW tylko z wektorami sympatii skierowanymi na opak.
Ja cały czas staram się przykładać te same miary do jednych i drugich. No i przykro mi, ale wychodzi, że ten Zachód (albo PO) jest nie gorszy Rosja (albo PIS), a w wielu aspektach jest lepszy; więcej — że wśród jego wartości są takie, które pokazują, że inna polityka jest możliwa i wcale nie musimy akceptować państwowego bandytyzmu.
PS.
A propos Jorge Viches:
https://euvsdisinfo.eu/the-saker-blind-loyalty-disguised-as-defiance/
mfizyk
31 MAJA 2022
10:34
Nie do konca rozumie co to jest „tryb narracyjny”.
Przypominam, że nasza dyskusja zaczęła się od tego Twojego komentarza:
mfizyk
30 MAJA 2022
16:40
Juz starzy Grecy wiedzieli, ze nikogo nie mozna niczego nauczyc. Bo kazdy musi sie sam nauczyc.
Tryb narracyjny, najogólniej i w największym skrócie, pomaga „uczyć się samemu” poprzez wkomponowanie nowych informacji w swoją prywatną historię. Poprzez przywoływanie kontekstu, który jest znany uczącemu się z własnego doświadczenia.
Na przykład łatwiej zapamiętać prawa fizyki przywołując anegdoty o wyskakiwaniu z wanny przez Archimedesa, czy jabłku spadającym na głowę Newtona. Przeprowadzanie eksperymentów z użyciem sprzętów kuchennych również pomaga przyswoić – uczynić swoimi – informacje, w tym informacje abstrakcyjne.
Gdybyś miał czas i był zainteresowany procesami uczenia, edukacji to polecam:
https://repozytorium.ukw.edu.pl/bitstream/handle/item/1544/Ewa%20Filipiak%20Z%20Wygotskim%20i%20Brunerem%20w%20tle%20s%C5%82ownik%20pojec%20kluczowych.pdf?sequence=1
@Bohatyrowiczowa
@mfizyk
Jeszcze w związku z zabawą i nauką.
Najskuteczniejszą formą nauki jest nauka poprzez zabawę. O czym wiadomo od dawna, ale teraz wiemy o tym coraz więcej dzięki badaniom nad edutainment inaczej edurozrywką (połączenie słów „education” i „entertainment”).
Na uwagę zasługuje paradygmat 9p badaczki Phyllis Tilson Piotrow.
kalvarya01
2 CZERWCA 2022
8:13
Meinen Sie „Arbeit macht Frei”?
Nie, nie chodzi o ten napis.
Chodzi o budowanie poczucia kompetencji i sprawstwa, które rozpoczyna się już w młodszym wieku szkolnym, wraz z rozpoczęciem nauki szkolnej, i powinno trwać do przysłowiowego „końca naszych dni”.
Praca, podobnie jak jedzenie, powinna być dostosowana do wieku, potrzeb i możliwości.
Zarówno jej nadmiar , jak i brak stają się przyczyną wielu patologii.
Na przykład kompulsywnej grafomanii blogowej.
Bez odbioru!
Jagoda 2 CZERWCA 2022 9:16
W ramach edukacyjnej zabawy proponuję dla nieco starszych dzieci „eduzabawę” pod nazwą „zbuduj sam małą bombkę atomową”.
Jagoda 2 CZERWCA 2022 9:26
Straszny jest u Ciebie ten brak poczucia humoru. :-(
SŁOWIANIN STANISŁAW 2 CZERWCA 2022 8:41
Tak, Europa i Ameryka Północna tracą znaczenie na rzecz Azji i to jest jak najbardziej naturalne. Przecież jeszcze na początku XIX wieku, to największymi gospodarkami świata były Chiny i Indie. Po prostu wszystko wraca do normalności, ale jak widać, to rodzi się ta normalność w ciężkich bólach.
PAK4 2 CZERWCA 2022 8:52
1. A płacisz Acan od tego podatek? Jeśli tak, to gdzie? Na Bahamach? ;-)
2. Kosowo stało się „etnicznie” albańskie niedawno temu. Tak samo Wielkopolska stała by się etnicznie germańska, gdyby nie I WŚ i upadek II Rzeszy. Bunt w Donbasie przeciwko banderowcom był zaś tak samo odgórnie sterowany, jak bunty Chorwatów czy Słoweńców przeciwko Serbom.
3. Swoją drogą, to kiedy Katalonia chciała ogłosić niepodległość, to NATO i EU poparły użycie siły przez Madryt przeciwko Barcelonie. Podobnie zostały krwawo stłumione dążenia Basków do niepodległości i do dziś Londyn krwawo tłumi dążenia Irlandczyków z okolic Belfastu do zjednoczenia się z ich Macierzą. Tak więc, że ten tego, z faktami jesteś Pan jakby na bakier.
3. Jeśli widzisz grzechy Zachodu, to dlaczego piszesz Acan tylko o grzechach Wschodu?
4. Popełniasz błąd logiczny we wnioskowaniu typu non sequitur (nie wynika) a polega on na tym, że z przesłanek danego wnioskowania nie wynika logicznie jego wniosek. W istocie błąd ten jest więc błędnym uznaniem za wnioskowanie dedukcyjnie wnioskowania niebędącego takim, gdyż z tego, że Waćpan jesteś przeciwko i Leninowi, i Korwinowi, i Kaczyńskiemu, i Putinowi, NIE wynika wcale, że jesteś Acan lewakiem.
5. Napisałem „tylko”, że przypisujesz Pan, Panie Szanowny, większości ludzi na świecie swoje, czyli zachodnie poglądy, wyznawane przez mniej niż 1/5 ludności świata, a nie, czy te poglądy sa „cacy” czy też „be”. Zresztą zimna wojna NIE skończyła się ponad 30 lat temu, a tylko złagodniały przejściowo jej objawy. Ruch państw niezaangażowanych się zaś nie sprawdził, gdyż kiedy na światowej arenie walczy ze sobą dwóch mocarzy, to nie można stać z boku i się temu przyglądać (chyba, że samemu jest się mocarzem), gdyż trzeba sie opowiedzieć za jednym z nich – otwarcie, czy też de facto, tak jak np. Szwecja i Szwajcaria stanęły de facto po stronie Hitlera, dopóki on zwyciężał.
6. Czy uważasz więc Waćpan, że wcale nie musimy akceptować państwowego bandytyzmu ze strony USA, UK, Izraela, Francji czy też innej Turcji?
PAK4 2 CZERWCA 2022 8:52
Przepraszam za błędy w numeracji. To wina mojego ordynansa.
W Kijowie Kaczyńskiego pasowali na Jarosława Mądrego … Tak sobie myślę prywatnie … podróże kształcą … a cudzy chwali …
Zbrojna czy ekonomiczna agresja na jakieś państwo jest naganna, obiektywnie rzecz biorąc.
Tyle że CZĘSTOTLIWOŚĆ takiego postępowania niektórych krajów jest wyjątkowo wysoka. Ale, to jakby temat tabu, nieakcentowany i nieakceptowany przez właścicieli zachodnich mediów.
Bardzo nieliczni dziennikarze podejmują ten temat, reszta woli nie draznić włascicieli mediów. Utrata dochodów to skuteczna metoda zastraszania.
Tyle na temat wolności prasy i mediów…..
Prostytutki medialne mają wyższe dochody niż normalne.
Problemy zdrowotne
Królowa brytyjska ma kłopoty z poruszaniem się, czemu jednak trudno się dziwić skoro ma 96 lat. Nie musi się jednak martwić bo rząd w zdrowych rękach.
O zdrowiu prezesa Kaczyńskiego niewiele wiemy, chociaż był taki okres gdy kulał, ale doszedł do sprawności. Na okładce tygodnika POLITYKA widzimy prezesa w pelerynie narodowej pod parasolem trzymanym przez prezydenta. Jak prezydent ratuje prezesa na stronach 14, 15 i 16.
Nie tylko prezydent, premier też dba o prezesa.
Prezydent USA dba o zdrowie. Widzimy jak rzeźko wspina się po schodach do samolotu i gładko zeń schodzi. Do tego ma jasno zarysowany plan wydarzeń, a nawet czasami wyprzedza wydarzenia, zawczasu ogłaszając co będzie i to się sprawdza.
Niestety nie wszyscy mają po drodze. Są też tacy przywódcy co im idzie jak po grudzie. Ciążąca na nich presja utrudnia podejmowanie decyzji i nie mogą się przezwyciężyć. Z biegiem czasu wszystko jednak może się zmienić, ostatecznie mają mocne argumenty na poparcie swoich zamierzeń
Na ładny i chyba aktualny kawałek natknąłem się podczas lektury.
Natknąłem się, ale nie przewróciłem. Wydaje mi się, że fragment mógłby stanowić motto niejednego panelu dyskusyjnego, czy blogowej debaty:
„Panie, Ty wiesz lepiej, aniżeli ja sam,
że się starzeję i pewnego dnia będę stary.
Zachowaj mnie od zgubnego nawyku mniemania,
że muszę coś powiedzieć na każdy temat
i przy każdej okazji.
Odbierz mi chęć prostowania każdemu jego ścieżek.
Uczyń mnie poważnym, lecz nie ponurym;
czynnym lecz nie narzucającym się…”
I pomyśleć, że za trzy lata minie okrągłe tysiąc lat od jego urodzin.
Znał facet życie.
PAK4
2 CZERWCA 2022
8:56
Kto opłaca działalność tej witryny?
Któras z trzyliterowych firm?
W propagandzie antyrosyjskiej przodują GB, USA, Kanada.
Ciekaw jestem dlaczego.
To wręcz obsesyjne.
Ps.
Białe Chełmy, czy Bellingcat też są opłacane z budżetu, tyle że brytyjskiego.
Agresywność Israela wobec Arabów jest niemal religijna … Tak sobie myślę prywatnie … dlaczego Żydzi godzą się na taki obciach …
T. Aquinas?
Jesli taki madry, to czemu taki glupi?
No takie czasy byly…. od liczenia dyablow i anyolow.
Serial Gwiazdy Lombardu … do lombardu przynoszą też łupy wojenne przodków z II WŚ wysyłane z frontu … Tak sobie myślę prywatnie … im się należało …
A tymczasem Chińczycy trzymają się mocno – „China’s first solar-tidal photovoltaic power plant connected to grid”. Podłączyli właśnie do sieci energetycznej hybrydową, fotowoltaiczno-przypływową elektrownię o mocy 100 MW. Gdzie indziej liczą anioły na szpilce, dżinny na pustyni (z naftą pod piaskiem), albo wymyślają nowe instrumenty pochodne na giełdę papierów wartościowych, czy też nowe bronie dla Ukrainy.
Kiedyś świat żywił ZSRR … teraz były ZSRR żywi świat … Tak sobie myślę prywatnie … widocznie bóg tak chciał …
@kalvarya01:
> 2. Kosowo stało się „etnicznie” albańskie niedawno temu.
Czyli? Jaka dawność Cię zadowala?
Zresztą, tak, czy siak, wcześniej Kosowo wcześniej stało się etnicznie albańskie, niż Krym stał się etnicznie rosyjski…
> Bunt w Donbasie przeciwko banderowcom był zaś tak samo odgórnie sterowany, jak bunty Chorwatów czy Słoweńców przeciwko Serbom.
Masz jakiś argument na to, poza „bo ja wiem lepiej”?
> Swoją drogą, to kiedy Katalonia chciała ogłosić niepodległość, to NATO i EU poparły użycie siły przez Madryt przeciwko Barcelonie.
Qrcze, przegapiłem bombardowanie Barcelony przez NATO…
Nie podoba mi się postępowanie wobec separatystów katalońskich, ale to nie jest żaden odpowiednik postępowania Rosji wobec Ukrainy; to nawet nie jest odpowiednik postępowania Putina wobec Nawalnego…
> krwawo stłumione dążenia Basków do niepodległości i do dziś Londyn krwawo tłumi dążenia Irlandczyków
Hm… Guernikę to zdaje się Twoi, z Legionu Condor bombardowali.
Jakaś obecna wojna w Irlandii Północnej? Pierwsze słyszę…
> Jeśli widzisz grzechy Zachodu, to dlaczego piszesz Acan tylko o grzechach Wschodu?
Bo byłoby to wyrwane z kontekstu.
Kontekst wpisu dotyczy błędów w rozumowaniu kreacjonistów; wraz z Kolegami wprowadziłeś pod blog temat błędów w rozumowaniu zwolenników Rosji w wojnie w Ukrainie.
> z tego, że Waćpan jesteś przeciwko i Leninowi, i Korwinowi, i Kaczyńskiemu, i Putinowi, NIE wynika wcale, że jesteś Acan lewakiem.
Ja sobie tak żartowałem, bo słowo „lewak” miał wymyślić Lenin, a w Polsce spopularyzować je, jego naśladowca z przeciwnej strony podejścia do gospodarki — czyli Korwin. Putina i Kaczyńskiego dodałem dla piękna towarzystwa. Mogłem dodać Salazara, Franco, Hitlera, czy Thatcher.
> Zresztą zimna wojna NIE skończyła się ponad 30 lat temu
Czyli między kim a kim się ona toczy?
30+ lat temu był blok wschodni i blok zachodni, realny socjalizm i realny kapitalizm.
To co później, to kwestie sentymentów rosyjskich za utraconym imperium, a nie starcie ideologii, wizji świata, państwa, gospodarki. No i Rosja nie ma tu sojuszników, żadnego serio bloku. Tzn. przepraszam, ma sojusznika — Białoruś. Bo nawet Kazachstan nie chce być za bardzo z Rosją kojarzony.
Można zerknąć na mapę poparcia na forum ONZ w przypadku Rosji i Ukrainy.
> Szwecja i Szwajcaria stanęły de facto po stronie Hitlera, dopóki on zwyciężał.
I dlatego Szwecja dzieliła się informacjami wywiadowczymi z Wielką Brytanią?
> Czy uważasz więc Waćpan, że wcale nie musimy akceptować państwowego bandytyzmu ze strony USA, UK, Izraela, Francji czy też innej Turcji?
Oczywiście, że nie musimy. Polskiego też nie musimy. Ani australijskiego.
Na pytanie, dlaczego bandyci najeżdżają różne kraje, kultury, jest prosta odpowiedź.
Zawarta w ST:
Czyńcie sobie Ziemię poddaną.
I robią to na wzór Narodu Wybranego, mordując, paląc, niszcząc.
Jak drzewiej w Judei, Palestynie.
Od Purytanów Cromwella, po chrześcijańskich syjonistów, wszystlo to opiera się na Biblii.
Sw. Tomasz z Akwinu nie tylko rachowal anioly.
Jego ‚Five Ways’ – 5 dowodow na istnienie Boga, to juz klasyka. Moj ulubiony to trzeci: the argument from contingency, co dlugo nie poddawal sie refutacji. Dzis to latwe cwiczenie z logiki…choc czy napewno?
https://www.britannica.com/topic/the-Five-Ways
erratum- na pewno…
Religa ci wszystko wybaczy … Tak sobie myślę prywatnie … o miłości do zabijania …
@act
Tak, zgadza się. Ten fragment pochodził z tablicy nagrobnej św. Tomasza z Akwinu.
Oczywiście za 3 lata minie osiemsetna rocznica Jego urodzin – baterie w liczydłach mi się wyczerpały.
@wiesiek
Ty wiesz wszystko.
Kilka dni temu obiegła się intrygująca informacja:
https://dorzeczy.pl/opinie/307393/media-rosjanie-unicestwili-centrum-miasta-w-8-sekund.html
Czy może wiesz o jakie miasto chodzi?
Próbowałem znaleźć, ale są trudności.
Niby Hiroszima swego czasu też miała problemy, ale jej nazwa nie zniknęła z map i globusów, ale tutaj widocznie miasto ( jego centrum) tak ucierpiało, że i jego nazwę spotkało nieszczęście.
Poważanie – co to za miasto?
Dziennikarze z poczuciem humoru
W najnowszych wiadomościach umieszczono fotografię gruzowiska z kobietą idącą z plastikowym workiem z takim napisem „Rosja zaęła miejscowość…(na Ukrainie)”
Pod „Biedronką” młody, dobrze zbudowany mężczyzna z narzuconą na ramiona ukraińską flagą zbierał datki.
Może jednak polski rząd wprowadzi jakieś zasady zbierania pieniędzy. Do takich sklepów nie chodzą z reguły majętni ludzie. Można też znaleźć jakieś lepsze zajęcie dla takich młodych obcokrajowców
Od kilkudziesięciu lat Henry Kissinger naucza, że hegemonia nad światem jednego z mocarstw oznacza całą serię wojen. Hegemon ciągle kogoś napada i dyscyplinuje, aż doprowadzi do narodzin sojusz wszystkich pozostałych mocarstw przeciwko niemu, co wywołuje serię wojen trwających tak długo, aż hegemon osłabnie i powróci zasada równowagi oparta na zgodzie mocarstw.
Dlatego Kissinger nie dążył nigdy do amerykańskiej hegemonii nad światem, chcąc podzielić się wpływami z Europą, ZSRR i z Chinami. Dlatego Donald Trump chciał uczynić tego sędziwego polityka swoim doradcą, rozumiejąc, że trwały pokój wynikać może tylko z podzielenia się przez USA władzą nad światem. Dlatego dziś Kissinger ostrzega Amerykanów, że popierając Ukrainę tworzą sojusz Moskwa-Pekin, co zwiastuje wojnę o hegemonię nad światem.
https://marucha.wordpress.com/2022/06/01/czyja-onuca-jest-henry-kissinger/
===========
Od zawsze, cenię pana Kissingera.
Należy do ginącej rasy REALISTÓW.
Fakt, służył zbrodniczym interesom Imperium.
Ale, służył dobrze.
Po nim przyszli partacze….
Izydor Danken
2 CZERWCA 2022
13:45
Nie wiem.
Front ma łączna długość ok. 3 000 km.
Setki wsi i miasteczek.
Na twitterze czy telegramie masz tysiące „wojennego porno” kręconych przez uczestników walk bądź przygodnych obserwatorów.
Ps.
Lekko retuszując starą anegdotkę….
Rozmawiają dwaj młodzieńcy.
-wiesz, jestem bezrobotny, dobrze płacą za wyjazd na safari.
pojadę, ustrzelę paru ruskich, wrócę z kasą.
-a jak ciebie zastrzelą?
-mnie? a za co?
Rzeczywisty obraz wojny jest zdecydowanie inny niż w hollywoodzkich obrazach.
Głód, smród, strach, stress.
Produkowane są kaleki fizyczne i psychiczne na masową skalę.
I po co?
Komu to potrzebne?
Zyski kompleksu militarno- przemysłowego, czy tez osiąganie celów zawartych w doktrynach politycznych, ideologii, nie usprawiedliwiają demolowania życia dziesiątek milionów ludzi na całym swiecie.
Ale tego żądnym zysku i władzy wytłumaczyć się nie da.
@wiesiek
Z tymi 3000 kilometrami frontu to chyba przesadziłeś?
Granica Rosji z Ukrainą to 1576 km.
@wiesiek59:
1) Kissinger ma 98 lat. Ja się zastanawiam, czy jeszcze wie co mówi.
2) Co do meritum to raczej nie wie: były stanowiska negocjacyjne i to Rosja uważała, że zdobycze terytorialne to za mało.
3) No właśnie się zastanawiam — pokazujecie, że nienawidzicie Ukrainy więc nie dziwi mnie, że życzycie Ukraińcom śmierci na froncie. Ale kibicując wojnie, kibicujecie też śmierci Rosjan. Co to za nienawiść?
Izydor Danken
2 CZERWCA 2022
14:31
Przyjrzyj się mapom, występom frontu, wklęsłościom.
Ukraina ma 604 km2.
Rosja zajęła około 150 000 Km2.
Na przykład, ta mapa wraz z omówieniem.
https://www.moonofalabama.org/12i/kherson1.jpg
PAK4
2 CZERWCA 2022
14:32
Jak tam sprawa nieingerencji w sprawy Ukrainy, zapisana w Memorandum Budapesztańskim?
Pani Nuland miała prawo finansować opozycję?
Jak tam realizacja Mińsk I i II?
Coś Ukraina zrobiła w tym kierunku?
Albo zachodni gwaranci?
Zorientuj się w temacie, bo jesteś raczej mało kompetentny, mówiąc delikatnie.
Powielasz jedynie narrację głównych mediów, wypierając wszelkie inne, bądź nie przyjmując ich do wiadomości, bo dysonans poznawczy jest zbyt duży.
Nawiasem mówiąc.
Żadna armia szkolona przez Amerykanów zgodnie z ich doktryną, i uzbrojona przez nich, nie wygrała żadnej wojny od 1950 roku.
Te marionetkowe armie to jedynie pralnie pieniędzy.
Odziani w łachmany pasterze kóz, chłopi z pól ryżowych, za każdym razem dają takim armiom łupnia.
To kwestia motywacji jest decydująca.
wiesiek59 2 czerwca 2022 14:04
Czy nie nasuwa się Tobie analogia do bitwy pod Stalingradem ? Atak oskrzydlający nacierającego nieprzyjaciela powoduje odcięcie go od źródeł zaopatrzenia w środki nieumożliwiające kontynuowanie walki.
To samo powtarzają właśnie Rosjanie w wojnie z Ukrainą – odciąć wojska ukraińskie atakujące Donbas.
W PRL marzeniem był wyjazd na/do kolonie … Tak sobie myślę prywatnie … a obiecywali Madagaskar …
kaesjot
2 CZERWCA 2022
14:51
Gdzieś pisałem juz o operacji Bagration w miniaturze…..
Widocznie tego w West Point jeszcze nie ma w programach nauczania…
@wiesiek59
Kontrofensywa pod Stalingradem to była operacja Uran Operacja Bagration to był raczej atak frontalny.
@wiesiek59
2 CZERWCA 2022
14:51
„Jak tam sprawa nieingerencji w sprawy Ukrainy, zapisana w Memorandum Budapesztańskim?”
Podaj dokladny cytat (i zrodlo). Bo w memorandum chodzilo o gwarancje integralnosci terytorialnej:
„The memorandum prohibited the Russian Federation, the United Kingdom and the United States from threatening or using military force or economic coercion against Ukraine, Belarus, and Kazakhstan,…”
https://en.wikipedia.org/wiki/Budapest_Memorandum_on_Security_Assurances#Content
Polityczne (i finansowe) wspieranie „swoich” nie bylo zabronione. I Putin to robil.
Wiec jeszcze raz, podaj CYTAT z tego Memorandum na dowod twojej interpretacji.
https://wyborcza.pl/7,75399,18319052,amerykanie-szkola-ukrainskich-nacjonalistow-podsylaja-ich-wladze.html
czyli szkolili. Amerykanie.
W nawiązaniu do tej (trochę zalinkowanej, ale wiadomo o co chodzi) ciekawa sugestia z „Propagandy XX wieku” po lekturze której łatwiej uzmysłowić sobie rozbieżność dwóch światów: wojny (ale nie tylko wojny) rzeczywistej i wojny podanej ludowi w mediach. Czasami naprawdę to, co mogą zrobić media robi wrażenie.
Czyli Amerykanie szkolą, a teraz „mój” cytat (wracamy do czasów wojny w Wietnamie):
„Wraz z każdym kolejnym zaangażowaniem i następująca po porażką cele USA zmieniały się i stawały się coraz gorzej zdefiniowane, i coraz bardziej niejasne, w miarę jak osoby uczestniczące w podejmowaniu decyzji o kontynuowaniu eskalacji usiłowały usprawiedliwiać swoje wcześniejsze działania. Początkowo celem USA było szkolenie Wietnamczyków, żeby bronili się sami. Kiedy stało się oczywiste, że nadzieja na osiągnięcie celu jest niewielka, wówczas celem stał się odwet za ataki Wietnamu Północnego, następnym zaś podniesienie morale południowowietnamskich sojuszników, a w końcu – niejasne pragnienie, aby” zwyciężyć za wszelką cenę”
Przechodząc na teren Ukrainy, w tym momencie Biden i jego administracja są na etapie podnoszenia morale ukraińskich sojuszników.
Swoją drogą, szukanie przez Polaków otuchy w amerykańskim sojuszniku (widząc co się dzieje na świecie) można jedynie odnieść do sytuacji kiedy jakieś państwo w 1913 szukało gwarancji dla swego bezpieczeństwa w monarchii Austro-Węgier.
Ale co zrobić, obecna klasa polityczna w Polsce tak akurat postrzega rzeczywistość i geopolityczne procesy.
kaesjot
2 CZERWCA 2022
15:33
Bagration odbywał się na tych samych terenach co obecnie.
Zajęto Białoruś i Ukrainę, docierajac do Wisły.
Tyle, że tamta armia była 10 krotnie liczniejsza niż obecna.
No i huraganowy atak artyleryjski z 11 000 luf, 6 000 czołgów, tysięcy samolotów, to nie jest modus operendi w tej operacji.
Kociołki są likwidowane delikatniej.
@wiesiek59:
Hm… a Rosja wypełniła swoje zobowiązania z protokołów mińskich? Bo z tego co widzę, to łamała je cały czas na potęgę.
PS.
Operacja Bagration obejmowała też okrążenia wojsk niemieckich. Tylko trochę to piszecie, jakby Stalin wynalazł historię wojskowości…
W Donbasie banderowcy nie atakują … to Rosjanie chcą wbić słupy graniczne za plecami banderowców … na granicy obwodów z rdzenną rosyjską ludnością … o czym zapomniał Gorbaczow … Tak sobie myślę prywatnie … w ramach rezerwatu Rosja …
Izydor Danken
2 CZERWCA 2022
15:58
Myslisz prawidłowo.
Amerykanie lubią wyciaganie kasztanów z ognia cudzymi rekami.
Szkolili UPA, WiN, Koreańczyków, Wietnamczyków, Talibow, ISIS, Contras, kubańskich uchodźców, Kurdów, Ukraińców, i diabli wiedzą jakie jeszcze formacje.
Poszły na to biliony- lub dziesiatki bilionów, o ile policzy się inflację dolara na przestrzeni 80 lat.
Jaki efekt poza stertą trupów liczonych w dziesiątkach milionów?
PAK4
2 CZERWCA 2022
16:01
Od kiedy Rosja jest stroną porozumień mińskich?
O ile wiem, Ukraińcy mieli dogadać się z secesjonistami?
Przy pomocy Niemiec i Francji?
Doczytaj proszę….
Sikorski i Sarkozy dogadali się z Janukowyczem.
Dzień później umowa była nieważna.
Tyle na temat zawierania umów pod patronatem zachodu.
NIGDY nie sa dotrzymywane.
To jest egzemplifikacja faktu, że „świat oparty na zasadach, wartosciach” jest jedynie medialnym bełkotem.
Wszystkie traktaty sa łamane w dowolnym- korzystnym- momencie.
A najmimordy znajda usprawiedliwienie na dowolny przekręt.
Ale ostatnio chyba Amerykanie dokonali pewnej korekty ( zresztą u siebie też to widać, czego dowodem Trump), bo oprócz akcentów patriotycznych, taki popierany czynnik polityczny, dobrze jeżeli jest połączony ze światem mediów, czy po prostu z fabułą. Dodajmy marnej raczej jakości.
Przecież Zelensky do gwiazda produktu Netflixu, a sponsorujący jego kampanię to magnat medialny Kołomojski, przedstawiciel jednej z mniejszości ukraińskich.
I chyba nic dziwnego, bo kto jak nie ludzie filmu, czy mediów wiedzą najlepiej jak tworzyć medialno-fabularny przekaz.
Bo takie zdarzenia jak te na Ukrainie to naprawdę wielki popis dla niebanalnych historii.
Zaczęło się to wszystko już na Wyspie Węży gdzie jak przekazywano…a okazało się, że są żywi i zdrowi.
I jak na moje wyczucie, sporo historii z Ukrainy rodem, to raczej tego typu medialno-fabularne faktoidy.
@wiesiek59
2 CZERWCA 2022
16:13
„Od kiedy Rosja jest stroną porozumień mińskich?”
Klamiesz w zywe oczy!
https://en.wikipedia.org/wiki/Minsk_agreements
mfizyk
2 CZERWCA 2022
15:53
Nieingerencja w sprawy wewnętrzne wymaga jakichś objasnień?
Termin nieznany dla ciebie?
Pani Nuland i jej 5 miliardów nie było ingerencją?
A wyimaginowane Russia Gate było?
Bank rosyjski udzielił swego czasu kredytu Le Pen.
Wrzask wielki.
Różne NGO finansowane z zachodu udzielały gigantycznych dotacji różnym swoim agencjom wpływu.
Sukces demokracji….
Zasady okreslane sa nie ze względu na ich trwałość, uniwersalność, tylko koniunkturalizm polityczny.
Jutro pan Xsiński dostanie dotację na stworzenie partii politycznej w Polsce, w kwocie powiedzmy swieżo wydrukowanych 100 milionów bagsów.
I wygra wybory, posługując się agencjami PR wyspecjalizowanymi w propagandzie politycznej.
To będzie w porzadku?
Tymiński był bliski sukcesu przecież….
Ile Kołomojski zainwestował w Żeleńskiego?
I patrz, jaki sukces.
Niekoniecznie akurat Ukraińców.
Ale, inwestycja na pewno się zwróciła- sponsorom.
Inwestycja w Jelcyna wynosiła chyba 60 milionó $.
Wyprowadzono dzieki niej aktywa warte 1,5 bilona $.
Cóż za stopa zwrotu!!!
Szanuję wszystkie poglądy, nawet te których nie podzielam.
O ile sa kulturalnie akcentowane.
Nie lubię jednak naiwności, idealizmu, infantylizmu, niewiedzy.
Mechanizm zdobywania i utrzymywania władzy został zapisany jakieś 5 000 lat temu.
I dalej jest aktualny.
Homo Sapiens brzmi co prawda dumnie, ale nie dotyczy 95% populacji.
To owce, albo lemingi.
Jeden z głównych punktów Mińska 2 zobowiązuje Kijów do przyjęcia nowelizacji konstytucji, która wprowadzi reformę decentralizacyjną z równoczesnym nadaniem szczególnego statusu „określonym powiatom obwodu donieckiego i ługańskiego”. Taki zapis byłby równoznaczny z nadaniem regionowi autonomii w ramach Ukrainy i faktycznym utrzymaniem odrębności separatystycznych republik. Ukraina wprawdzie przygotowała projekt odpowiedniej ustawy o zmianie konstytucji, jednak wprowadzenie doń możliwości nadania szczególnego statusu tym powiatom wywołało gwałtowny sprzeciw znacznej części deputowanych i w efekcie zablokowało uchwalenie tej nowelizacji (projekt nie może liczyć na większość konstytucyjną). W rezultacie połączenie kwestii decentralizacji ze sprawą „specjalnego statusu” dla części Donbasu w istocie zablokowało tę niezwykle potrzebną Ukrainie reformę.
https://www.osw.waw.pl/pl/publikacje/analizy/2016-02-10/porozumienie-minskie-rok-gry-pozorow
===========
Rosja jest taką samą stroną, jak Francja i Niemcy.
Ma NADZOROWAĆ wprowadzenie w zycie postanowień.
Jak wyżej napisano, nie zrobiono tego nigdy.
@Herstoryk 11:25
Gdzie indziej liczą anioły na szpilce, dżinny na pustyni (z naftą pod piaskiem), albo wymyślają nowe instrumenty pochodne na giełdę papierów wartościowych, czy też nowe bronie dla Ukrainy.
Chwała Chinom za zieloną elektrownię ale Twój powyższy komentarz mija się z prawdą. Chiny wyprzedziły Amerykę w udziale energii ze źródeł odnawialnych ale jeszcze nie znalazły się wśród 10 najbardziej innowacyjnych krajow. “Gdzie indziej” nie zajmują się wyłącznie innowacjami w finansach i broni (zresztą te drugie znajdują z czasem szerokie zastosowanie w produkcji pokojowej).
The U.S. is the largest producer of high-technology manufacturing (31 percent global share). This includes production of aircraft and spacecraft, semiconductors, computers, pharmaceuticals, and measuring and control instruments. China is second at 24 percent, more than doubling its share over the last decade.
https://www.sciencedaily.com/releases/2018/01/180124113951.htm#:~:text=The%20U.S.%20is%20the%20largest,share%20over%20the%20last%20decade.
Królowa brytyjska … kiedy mordowała ludność Irlandii nie była nazywana zbrodniarzem wojennym … Tak sobie myślę prywatnie … bo o królowej nie wolno mówić żle … my dżentelmeny mamy zasady … o Aborygenach nie wspomnę …
Dla osob zainteresowanych swiadomoscia
Quantum mechanics suggests that particles can be in a state of superposition – in two states at the same time – until a measurement take place. Only then does the wavefunction describing the particle collapses into one of the two states. According to the Copenhagen interpretation of quantum mechanics, the collapse of the wave function takes place when a conscious observer is involved. But according to Roger Penrose, it’s the other way around. Instead of consciousness causing the collapse, Penrose suggested that wavefunctions collapse spontaneously and in the process give rise to consciousness. Despite the strangeness of this hypothesis, recent experimental results suggest that such a process takes place within microtubules in the brain. This could mean that consciousness is a fundamental feature of reality, arising first in primitive bio-structures, in individual neurons, cascading upwards to networks of neurons, argues Roger Penrose collaborator Stuart Hameroff.
Książę Karol, królowa Elżbieta II, księżna Kate i William z dziećmi, na fotografii w czasie obchodów platynowej rocznicy panowania brytyjskiej monarchini robią wrażenie na poddanych i gościach tej uroczystości.
Tylko grupa aktywistów domaga się pokojowo od królowej zwrotu ziemi. Grunt to ziemia, mówią nie tylko w Londynie.
Brytyjczykom pozostały uroczystości. Panowanie nad światem przejęli już inni.
Nagonka na Putina przypomina Dekabrystów: Zabić cara … ! Tak sobie myślę prywatnie … jakie to prymitywne odruchy w wykonaniu tzw. zachodniej cywilizacji …
Od wczoraj patrzę na okładkę tygodnika POLITYKA (poza meczami w Paryżu) i muszę pogratulować Ireneuszowi Szuniewiczowi za ilustrację jak prezydent ratuje prezesa.
Wśród wydarzeń krajowych to robi spore wrażenie
@ wiesiek59
2 CZERWCA 2022
16:29
„Nieingerencja w sprawy wewnętrzne wymaga jakichś objasnień?”
Prosilem o CYTAT, gdzie ten terminus wystepuje w porozumieniach Minskich. Nie podales, bo go tam NIE ma. Znowu sobie cos zmysliles 🙁
O czym ty nieustannie piszesz? O swoich zwidach, marzeniach, snach?? No, bo o faktach to juz tylko okazjonalnie 🙁
@ wiesiek59
2 CZERWCA 2022
16:37
„Rosja jest taką samą stroną, jak Francja i Niemcy.
Ma NADZOROWAĆ wprowadzenie w zycie postanowień.”
Dobrze, ze sie doksztalciles. Ale po co pisales najpierw nieprawde? Bo ci bylo z tym „po drodze”? Dowodzisz tym tylko, ze twoje rozumowanie nie jest objektywne, tylko intencjonalne (pod zadana teze) 🙁
Slawomirski 17:47,
a i owszem ‚zainteresowani’.
Ostatnio ten wywiad:
https://youtu.be/Qi9ys2j1ncg
Zreszta Penrose, to tylko jeden z glosow w sprawie: ‚the insoluble problems of philosophy’.
Wszystkie, moim zdaniem, bladza…ale brzmia pieknie.
P. S. wole okreslenie: ‚intractable problems’ zreszta.
Lubie tez, kiedy ‚platonista’ Penrose mowi o bytach matematycznych.
https://www.cantorsparadise.com/platonist-roger-penrose-sees-mathematical-truths-61a45840fe00
W dniu kiedy Przewodnicząca Komisji Europejskiej Ursula von der Leyen przywozi polskiemu rządowi pieniądze, dowiadujemy się, że każdy może uzbierać sobie w lesie chrustu jak uzyska zgodę leśniczego.
To dobra wiadomość dla tych, których nie stać na zakup węgla, co niestety trochę podrożał.
Wcześniej namawiano do jazdy rowerami, co pozwoli oszczędzić na benzynie. Jeszcze nie przedłożono programu oszczędności gazu. Od lat były prezentowane różne technologie produkcji tego paliwa oparte na węglu czy biogazie, ale nie wyszły poza fazę przygotowawczą. Mówią, że potrzeba jest matką wynalazków. Nastał chyba odpowiedni czas aby to porzekadło sprawdziło się w życiu. Bo inaczej trzeba będzie jednak iść do lasu po chrust
Jeszcze o tej drugiej wojnie. Wojnie informacyjnej. Wojnie prowadzonej za pomocą mediów.
Ponownie „Wiek propagandy”.
Rzecz dzieje się w 1990 roku, czyli 32 lata temu.
Przed pierwszą wojną z Irakiem.
Prezydent Bush aby sensownie uzasadnić wojnę postanowił…nie, nie wystąpić z orędziem do narodu, ale zlecił wykonanie zadania firmie PR, a ta jak każda porządna firma public relations wywiązała się ze zlecenia na piątkę.
Teraz cytat z „Wieku…”:
„Siedemset stacji telewizyjnych pokazało 15.09. 1990 roku film, w którym zapłakana piętnastolatka opowiada o bestialstwie żołnierzy irackich zabijających dziesiątki kuwejckich niemowląt, a prezydent Bush(senior) powoływał się na ten film uzasadniając interwencję wojskową w Iraku. Tymczasem okazało się, że film powstał na zamówienie rządu Kuwejtu przez firmę PR, a płacząca dziewczyna była córką ambasadora Kuwejtu w USA i w 1990 roku mieszkała w Waszyngtonie”.
Niezłe!
Tak było 32 lata temu i widząc postęp w tej dziedzinie wypada zadać pytanie: Ile firm PR ( również czarnego) pracuje na potrzeby konfliktu na Ukrainie?
Po obydwu zresztą stronach.
Chyba tylko skromnosc Penrose’a dorownuje jego wiedzy i wyobrazni. To jego: nie wiadomo, czy tak jest ale moze tak byc, zapada w pamiec.
On woli mowic o eonach eonow czasu niz o Bogu, ktory, dla niego a mowi to najwybitniejszym teologom-filozofom, ‚nic nie wnosi do dyskursu’.
Delightful zaiste.
https://youtu.be/7o0gAglNdZw
act
2 CZERWCA 2022
19:47
Do dzis wiedza na temat narkozy nie jest pelna. A pierwsza narkoza miala miejsce w Boston w 1846 roku. Czas najwyzszy zrozumiec jak materialny gas gasi swiadomosc.
https://iai.tv/articles/consciousness-is-the-collapse-of-the-wave-function-auid-2120
@is42
U nas, na wsi, w ramach solidarności z narodem ukraińskim organizowane są zapisy na kurs „Prawa jazdy woźnicy” ( rząd szykuje projekt ustawy w trybie przyśpieszonym w tej sprawie).
Ma facet w sąsiedniej wsi sporą stadninę koni, paliwo raczej nie stanieje i ludzie kombinują. Koń będzie, starego malucha wyciągnie się ze stodoły, dyszel przyspawa i sankcje wobec Rosji ludziom nie straszne.
Jest jeden nawet, co kuźnie zamierza otwierać, bo konia przecież podkuć trzeba.
A i do lasu po drzewo i chrust koniem chyba łatwiej.
Slawomirski,
kula w tyl glowy tez i co z tego?
Wtedy ‚doswiadczamy’ Nicosci ale to przerabialismy przed urodzeniem.
Co Ty z ta narkoza ciagle? 🙂
Rozdzielenie polkul mozgowych produkuje dwie swiadomosci w jednym ciele – to dopiero jest temat.
PAK4 2 CZERWCA 2022 11:29
- Kosowo stało się „etnicznie” albańskie niedawno temu, jeszcze za Tito, ktory chciał dać Panubogu świeczkę a Diabłu ogarek i tym samym nie zadowolił on nikogo.
- Bunt w Donbasie przeciwko banderowcom był zaś tak samo odgórnie sterowany, jak bunty Chorwatów czy Słoweńców przeciwko Serbom. Poczytaj o tym, ale nie w zachodnich, kłamliwych mediach.
- Swoją drogą, to kiedy Katalonia chciała ogłosić niepodległość, to NATO i EU poparły użycie siły przez Madryt przeciwko Barcelonie. I ta siła oznacza niekoniecznie zaraz bombardowanie Barcelony przez NATO, na wzór Belgradu.
- Krwawo stłumione dążenia Basków do niepodległości i to, że do dziś Londyn krwawo tłumi dążenia Irlandczyków to są fakty. Konflikt w Irlandii Północnej (ang. The Troubles czyli kłopoty), jest to konflikt o podłożu etniczno-politycznym rozgrywający się na obszarze Irlandii Północnej, okresowo rozszerzający się również na Anglię, Irlandię i kontynentalną Europę, trwający od końca lat 1960-tych aż do podpisania porozumienia wielkopiątkowego w Belfaście w roku 1998. Jednak pomimo podpisania tego porozumienia pokojowego, to nadal jednak dochodzi do sporadycznych aktów przemocy. Poza tym, to ja nie jestem z III Rzeszy.
- Jeśli widzisz grzechy Zachodu, to dlaczego piszesz Acan tylko o grzechach Wschodu? Bo NIE jesteś obiektywny.
- Marnie sobie żartowałeś. Być może termin „lewak” wymyślił tow. Lenin („Dziecięca choroba ‘lewicowości’ w komunizmie”), ale co z tego?
- Zimna wojna NIE skończyła się ponad 30 lat temu ale toczy sie ona wciąż miedzy USA i jego wasalami a Rosją i Chinami. A ONZ jest dziś w takimi stanie, jak Liga Narodów w roku 1939.
- Szwecja i Szwajcaria stanęły de facto po stronie Hitlera, dopóki on zwyciężał. I co z tego, że Szwecja dzieliła się informacjami wywiadowczymi z Wielką Brytanią? Nie walczyła ona z Hitlerem ale go zaopatrywała w surowce i broń i tylko to się liczy.
- Mowa była a o USA, UK, Francji, Izraelu a nie o pionkach typu Polski czy Australii.
Serdeczności etc.
act 2 CZERWCA 2022 20:37
Lem „Pokój na Ziemi”.
act 2 CZERWCA 2022 12:14 -„Argumenty” Tomasza z Akwinu”:
- Pierwsza droga „z ruchu” (ex motu) wychodzi z błędnego założenia, że ruch wymaga siły sprawczej. Ale już Newton odwodnił, że każde ciało trwa w swym stanie spoczynku lub ruchu prostoliniowego jednostajnego, jeżeli siły przyłożone nie zmuszą ciała do zmiany tego stanu.
- Druga droga „z istnienia przyczyny sprawczej” – kto jest więc sprawcą istnienia Boga?
- Trzecia droga „z istnienia rzeczy niekoniecznych” wychodzi od stwierdzenia kruchości i przemijalności wszystkiego tego, co nas otacza, ale to nie znaczy, że Bóg istnieje.
- Czwarta droga „ze stopni doskonałości” (ex gradibus perfectionis) to typ rozumowania, które wychodzi od stwierdzenia, że w otaczającym nas świecie istnieją byty o różnej doskonałości, ale to znaczy, że może istnieć byt jeszcze doskonalszy od Boga.
- Piąta droga „z ładu i celowości w świecie” (ex gubernatione rerum) uwzględnia aspekt porządku w świecie, ale dziś wiemy, ze wszechświat dąży do chaosu, do wzrostu entropii.
Izydor Danken 2 CZERWCA 2022 16:23
Ten chazarski komik, postawiony przez CIA i Mosad na czele Ukrainy, jest tylko żałosnym debilem.
act 2 CZERWCA 2022 19:47
Byty matematyczne istnieją tylko w umysłach matematyków.
Slawomirski 2 CZERWCA 2022 17:47
Penrose suggested – czyli że on tylko sugeruje, ale nie ma na to żadnych dowodów empirycznych. A ja uważam, że dualizm cząstkowo-falowy wyjaśnił dawno temu Einstein, twierdząc że cząstka jest „zagęszczeniem” fali, co obserwujemy np. rzucając kamień na na stojącą wodę.
SŁOWIANIN STANISŁAW 2 CZERWCA 2022 10:57
Agresywność Izraelczyków czyli Chazarów wobec Arabów a szczególnie Palestyńczyków jest niemal w 100% religijna.
SŁOWIANIN STANISŁAW 2 CZERWCA 2022 11:29
Bóg jak Bóg, ale na pewno prawosławna Trójca Święta.
wiesiek59 2 CZERWCA 2022 10:46
Także więcej niż trzyliterowe, np. M____d.
Izydor Danken 2 CZERWCA 2022 10:41
Te swoje rady, to zachowaj lepiej dla siebie. ;-)
Narkoza eterowa do tej pory jest zagadka dla wiekszosci anestezjologow. O ich pacjentach lepiej nie mowic. Alkoholizuja sie i oglupiaja dymem z wysuszonych lisci.
Poznanie swiata zaczelo sie od pierwswzych zywych mikroorganizmow. Reszte prosze sobie dopowiedziec lub doczytac.
s42 2 CZERWCA 2022 10:41
Królowa brytyjska a też i australijska, czyli moja, ma kłopoty nie tylko z poruszaniem się, ale i ze zdrowiem psychicznym, gdyż gdyby była ona zdrowa na umyśle, to w tym jakże zawansowanym wieku, dawno temu już by abdykowała. Swoją droga, to (nomen omen) Borys o nazwisku Dżonsyn też nie jest człowiekiem zdrowym psychicznie. Obecny prezydent USA jest zaś dzisiejszym Breżniewem – jest on zdalnie sterowanym mechanizmem, pokrytym powłoką imitująca ludzką skórę. Ale coraz częściej jego serwomechanizmy zawodzą, a co widać jest na filmach dostępnych w Sieci.
Slawomirski 2 CZERWCA 2022 21:40
Życie jest do tej pory jest zagadką dla nauki.
„Argumenty” Tomasza z Akwinu”:
- Pierwsza droga „z ruchu” (ex motu) wychodzi z błędnego założenia, że ruch wymaga siły sprawczej. Ale już Newton odwodnił, że każde ciało trwa w swym stanie spoczynku lub ruchu prostoliniowego jednostajnego, jeżeli siły przyłożone nie zmuszą ciała do zmiany tego stanu.
- Druga droga „z istnienia przyczyny sprawczej”(ex ratione causae efficientis) – kto jest więc sprawcą istnienia Boga?
- Trzecia droga „z istnienia rzeczy niekoniecznych” (ex possibili et necessario) wychodzi od stwierdzenia kruchości i przemijalności wszystkiego tego, co nas otacza, ale to nie znaczy, że Bóg istnieje.
- Czwarta droga „ze stopni doskonałości” (ex gradibus perfectionis) to typ rozumowania, które wychodzi od stwierdzenia, że w otaczającym nas świecie istnieją byty o różnej doskonałości, ale to znaczy, że może istnieć byt jeszcze doskonalszy od Boga.
- Piąta droga „z ładu i celowości w świecie” (ex gubernatione rerum) uwzględnia aspekt porządku w świecie, ale dziś wiemy, ze wszechświat dąży do chaosu, do wzrostu entropii.
act 2 CZERWCA 2022 12:14 -„Argumenty” Tomasza z Akwinu”:
- Pierwsza droga „z ruchu” (ex motu) wychodzi z błędnego założenia, że ruch wymaga siły sprawczej. Ale już Newton odwodnił, że każde ciało trwa w swym stanie spoczynku lub ruchu prostoliniowego jednostajnego, jeżeli siły przyłożone nie zmuszą ciała do zmiany tego stanu. Oraz: kto jest sprawcą istnienia Boga?
Szalom i dobranoc.
Chrust leśny, podobnie jak kiedyś „leśne ruchadło” z którym konwersował prezydent, przebił się w mediach.
Już pojawiają się propozycje sprzedaży chrustu, kupna wózków do przewożenia chrustu i inne.
Nawet proponowana jest reaktywacja elektrowni w Ostrołęce z paleniem chrustem.
Chrust jest z nami!
Idę spać przekonany o wielkiej roli chrustu w życiu narodu.
Benzyna 98 na Orlenie po 8,52 zł/litr.
@Redes22 2 czerwca 2022 16:50
Chwała Chinom za zieloną elektrownię ale Twój powyższy komentarz mija się z prawdą.
Komentarz był o charakterze conieco satyrycznym,, a satyra zawsze przesadza.
Na poważnie, jeśli obecne trendy będą kontynuowane ChRL wkrótce wyprzedzi USA w innowacyjności technologicznej i naukowej. Jakiś czas temu czytałem rzeczowy artykuł na ten temat, naświetlający przy okazji chiński problem z rozwojem wynalazczości, a mianowicie rygorystyczny, pozbawiony elastyczności i swobody system kształcenia, od podstawówki do uniwersytetu. Mimo to jednak ilość (zarówno absolwentów, jak i pieniędzy przeznaczanych na naukę) przechodzi tam w jakość.
Nie pamiętam gdzie był, znalazłem inny, NSF rolls out huge makeover of science statistics, z interesującym porównaniem liczby publikacji naukowych w wykresie kolumnowym, i jej %% wzrost w różnych krajach. Co ciekawe to to, że wskazuje iż liderami w tym wzroście są kraje zdecydowanie nie-zachodnie, po kolei Iran, Indie, Rosja, Chiny i Brazylia. Czyli jakby zmierzch (pun intended) Zachodu.
PS. Czy pominięcie Polski w wykresie jest skutkiem koncentracji polskich …..ahem…. naukowców (w znacznej części ks. ks. dr. od Łaski Nieustającej) na liczeniu aniołów na szpilce, czy cienkim stanem polskiej nauki, czy po prostu zbyt wielką liczbą krajów z podobnymi statystykami ??
ls42 2 CZERWCA 2022 22:50
Chrust jest ekologiczny i zdrowy dla osób go zbierających. Będę nim „karmił” moją podwarszawską „kozę”, gdyż nie stać jest mnie na gaz importowany z Norwegii czy też z Bliskiego Wschodu, a gaz amerykański jest na dodatek nie-ekologiczny, gdyż pochodzi z tzw. łupków, czyli z dewastacji środowiska.
Swoją drogą zapowiada się, że z uchwaleniem tzw. ustawy chrustowej nie będzie żadnych kłopotów. Opozycja zgodziła się poddać głosowanie pod aklamacje. Na dowód, że polityka sankcji wobec Rosji zyskała ogólnospołeczną akceptację, główne polskie media (Polityka chyba też) przygotowują specjalny dodatek do swoich jesiennych wydań zatytułowany „Tylko z nami przetrwasz zimę i dojedziesz na czas do teściowej”. Ten drugi człon tytułu biuletynu związany z wahaniami cen paliwa.
Czyli zima, ale i inne pory roku, Polakom nie powinny być straszne.
Herstoryk 3 CZERWCA 2022 2:57
Nic dodać, nic ująć. ChRL wkrótce wyprzedzi USA w innowacyjności technologicznej i naukowej, a liderami w jej wzroście są od dłuższego już czasu kraje zdecydowanie nie-zachodnie, czyli Iran, Indie, Rosja, Chiny i Brazylia. Oznacza to oczywiście zmierzch Zachodu a pominięcie Polski w w/w wykresie jest skutkiem koncentracji polskich …..ahem…. naukowców (w znacznej części ks. ks. dr. dr. hab. hab. od Łaski Bożej Nieustającej etc.) na liczeniu aniołów na szpilce i związanym z tym „cienkim” stanem polskiej nauki:
https://www.academia.edu/42852860/A_proposal_to_reform_Polish_science_and_Polish_tertiary_education_system_Propozycja_reformy_polskiej_nauki_i_polskiego_szkolnictwa_wyższego_
Powyższe, to jest oczywiście głos wołającego w puszczy, czy też raczej na naukowej pustyni, jaką stała się Polska po deformach tow. Balcerowicza i ski oraz rządach takich tytanów intelektu i wiedzy jak TW Bolek (Prawie że Elektryk), „mgr” Kwaśniewski, hrabia Komurski czy też „doktór” praw, czyli niejaka Duda.
Szalom!
Izydor Danken 3 CZERWCA 2022 6:45
Z chrustu można „wydobyć” tzw. Holzgas, na którym dojedziesz „maluchem” na czas do teściowej oraz przetrwasz zimę. I to na serio:
Gaz drzewny, inaczej Holzgas, jest gazem generatorowym produkowanym w procesie zgazowania z drewna w urządzeniu zwanym gazogeneratorem. Składa się przede wszystkim z wodoru (około 20% objętości), tlenku węgla (około 20%) i niewielkich ilości metanu oraz niepalnego azotu (około 50-60%) a także dwutlenku węgla i pary wodnej, które powstają podczas jego spalania. Paliwo to może być stosowane do zasilania silników spalinowych i innych urządzeń, np. kotłów c.o. – Wikipedia (https://de.wikipedia.org/wiki/Holzgas).
Mauro Rossi 1 CZERWCA 2022 22:07
Powtarzam, że ateizm, „jako taki”, jest naturalnym stanem człowieka, wszystkich ludzi i że religia w sensie jej instytucjonalizacji w postaci kościołów etc. została wymyślona przez wczesnych właścicieli niewolników, aby usprawiedliwić ich okrutne rządy. Natomiast owe pochówki rytualne etc. to tylko dowód tego, że człowiek pierwotny nie za bardzo radził sobie z siłami natury i nie mogąc ich opanować, starał się im przypodobać, antropomorfizując je. Ale później przyszła nauka i dziś człowiek myślący nie może już być człowiekiem religijnym.
Z kolei malarstwo naskalne, to zjawisko typowo artystyczne, a nie sakralne. I nie ma też czegoś takiego jak świadomość religijna, gdyż obiektywnie istnieje tylko NIEświadomość religijna. Odejście pierwotnego człowieka od rozumu i zawładnięcie nim przez zabobony, gusła, czary etc. to smutny epizod w dziejach ludzkości.
Natomiast nauka, oprócz pseudonauki wykładanej np. na KUL, potwierdza tezę o pierwotnym ateizmie, gdyż religia jest to wymysł oszustów i szalbierzy, ignorujących naukę i rozum. Zresztą wiara nie da się pogodzić z wiedzą, gdyż -albo coś wiesz, albo też w coś wierzysz. Tu akurat tertium non datur.
Szalom!
@
Wiezy zycia sa … i male i duze.
Stad blogowi przyslosci wielkiej nie wroze.
Skad zapewne kalavaryo umeczona pieprzysz cos o polskich czcionkach, majacych usprawiedliwic twa sraczke slowna brakiem znakow diakrytycznych.
Pewien pan strzelal celnie w bramke.
Lecz mial z tylu na spodniach mala plamke.
Innymi slowly jako blogowy figo fago jestes milym facetem, ktorym troche brzydko z pupy pachnie.
Ot taki komentarz od kogos kto uwaza siebie za nic .
Zajelo mi to 70 lat.
Aborygen 3 CZERWCA 2022 7:16
Kolejny biedak, którego nie stać jest na polską czcionkę. Ale może „Centerniak” ci pomoże albo też Święty Wincenty lub jakaś inna Armia Zbawienia?
C.d. US-sagi:
USA. Strzelaniny przed kościołem i na pogrzebie. Trzy osoby nie żyją. Biden wzywa do większej kontroli rynku broni
Oprac. Marcin Kozłowski, IAR 03.06.2022 06:46
Trzy osoby nie żyją po strzelaninie, do której doszło w czwartek na parkingu przed kościołem Cornerstone na wschód od miasta Ames w stanie Iowa. Strzały padły również na pogrzebie w Wisconsin. Tuż przed zdarzeniami prezydent Stanów Zjednoczonych Joe Biden wezwał Kongres do wprowadzenia większej kontroli rynku broni.
To kolejne takie zdarzenia w USA w ostatnich tygodniach. W tym tygodniu napastnik zastrzelił na terenie szpitala w Oklahomie cztery osoby, po czym popełnił samobójstwo. Strzelanina w szpitalu miała miejsce zaledwie osiem dni po tym, jak osiemnastolatek zastrzelił 21 osób w szkole podstawowej w Teksasie i niewiele ponad dwa tygodnie po strzelaninie w stanie Nowy Jork, gdzie zginęło 10 osób.
Radio TOK FM informuje o sprzedaży przez Polskę Ukrainie broni za 3 miliardy złotych. Redaktor Jacek Żakowski uważa, że tę broń my powinniśmy im dać, a nie sprzedawać.
Ależ w czym rzecz? Sprzedać, to jak dać.
Inną poranną wiadomością jest zajęcie przez Rosję 1/5 terytorium Ukrainy powiedział prezydent Zełenski. Minęło 100 dni od początku „operacji specjalnej”.
Nie wchodząc głębiej redaktor Żakowski ubolewa, że prasa zbyt mało miejsca na łamach poświęca wydarzeniom na Ukrainie.
Czy też tak uważacie? Ja mam odmienne zdanie. O tym mówi i pisze się bez przerwy, ale co z tego wynika?
Rosja kontroluje jedną piątą Ukrainy (NYT)
Prezydent Ukriny, Rabin Wołodymyr Zełenski powiedział, że siły rosyjskie zajęły 20% terytorium Ukrainy, podczas gdy wojna zbliża się do setnego dnia. Powiedział, że Rosja rozszerzyła swoją kontrolę nad terytorium Ukrainy z obszaru mniej więcej wielkości Holandii przed inwazją na obszar obecnie większy niż Holandia, Belgia i Luksemburg razem wzięte.
Rabin Zełenski powiedział, że walki toczyły się na linii frontu, która rozciągała się „ponad 1000 kilometrów”. Na północnym krańcu siły rosyjskie próbują okrążyć Charków. W kierunku południowym Ukraina twierdziła, że kontrofensywa osiągnęła zyski w pobliżu Mikołajowa.
Zachodni urzędnicy mają nadzieję, że broń z USA i Niemiec może pomóc Ukraińcom odwrócić losy wojny, zwłaszcza na wschodzie, gdzie Moskwa nadal koncentruje się na zdobyciu Siewierodoniecka, pomimo zaciekłego oporu ze strony Ukraińców. Jest to ostatnie miasto w obwodzie ługańskim, które nie jest pod kontrolą Rosji. Rabin Zełenski oskarżył Rosję o przymusową deportację ponad 200 000 ukraińskich dzieci od początku wojny i powiedział, że od początku wojny zginęło około 14 000 ukraińskich cywilów i członków służby.
HIPOKRYZJA ZACHODU WEDŁUG NYT, czyli Biden udaje się w podróż do Arabii Saudyjskiej.
Prezydent Biden uda się w tym miesiącu do Arabii Saudyjskiej, aby odbudować zniszczone relacje – i obniżyć ceny gazu w USA. Posunięcie to jest zwrotem w jego polityce, gdyż jako kandydat Biden przysiągł ukarać bogate w ropę królestwo za brutalne zabójstwo Jamala Khashoggiego i uczynić Saudyjczyków „pariasem, jakim są”. Ale sytuacja na świecie się zmieniła. Po rosyjskiej inwazji na Ukrainę Biden musi zabiegać o innych producentów energii, aby odizolować Moskwę, wymienić jej ropę i ustabilizować światowe rynki. Ma on też na uwadze względy polityczne: ceny gazu są również wysokie w USA i mogą nie spaść przed kluczowymi terminami w listopadzie, pomimo zapewnień, że kraje OPEC Plus skromnie podniosą produkcję ropy o 50% więcej niż planowano na lipiec i sierpień.
Szczegóły: W tym miesiącu w Rijadzie Biden planuje spotkać się z księciem koronnym Mohammedem bin Salmanem, uznanym za odpowiedzialnego za zabójstwo Khashoggiego, oraz z kilkoma przywódcami arabskimi.
Analiza: Eksperci ds. polityki zagranicznej stwierdzili, że wizyta stanowi triumf realpolitik nad moralnym oburzeniem. Stany Zjednoczone już zacieśniły współpracę z Arabią Saudyjską, w tym w związku z dwumiesięcznym rozejmem w Jemenie, w którym pośredniczyły ONZ, który został wczoraj przedłużony.
Administracja Trumpa: komisja Izby Reprezentantów bada, czy Jared Kushner sprzedał swoją pozycję rządową, aby zainwestować 2 miliardy dolarów w swoją nową firmę private equity od znanego saudyjskiego funduszu majątkowego.
W tle wizyty Bidena majtki Nawalnego … Tak sobie myślę prywatnie … majtki sprowadziły świat na krawędż światowego konfliktu …
PAK4 2 CZERWCA 2022 11:29
Jak skomentujesz oficjalną wizytę Bidena w czołowej demokracji świata, czyli w Arabii Saudyjskiej?
SŁOWIANIN STANISŁAW 3 CZERWCA 2022 8:08
Raczej majątki niż majtki, ale Biden będzie też mieć problem z majtkami podczas tej wizyty u Saudów – sojusznika nr 1 USA a więc też i Polski wśród krajów arabskich, w tej czołowej demokracji świata.
Szalom!
Morze Azowskie morzem wewnętrznym … Most Krymski łukiem triumfalnym … Tak sobie myślę prywatnie … festina lente … ! Gorbaczow może być zadowolony … Putin prostuje niedoróbki rozwiązania ZSRR … Trump i Israel ze Wzgórzami Golan dali przykład … jak czynić ziemię poddaną …
Komentarz z cyklu „Polak potrafi”.
Na rynku będą konkurować dwa takie same produkty – ropa amerykańska, arabska i inna w cenie 120 dol. i rosyjska z dużym dyskontem sięgającym 30 dol. za baryłkę.
‚Trefną” ropę rosyjską kupować będą Węgrzy, a Polska i reszta europejskiej wspólnoty ropę z moralnym certyfikatem po 120 dol ( na ten moment) za baryłkę.
A chodziło w sumie tylko o neutralność Ukrainy.
Swoją drogą skoro Węgrzy puścili Rosji w niepamięć 1956 rok, Izrael zapomniał Niemcom Holocaust, to prawdopodobnie za kilka lat i Ukraina i Rosja wzniesie toast kwasem chlebowym na zgodę.
A za kilka lat Ameryka zwinie manatki z Europy i Polska zostanie…albo i nie zostanie.
Cała nadzieja w idei słowiańszczyzny popularnej kiedyś w Rosji i może po wyznaniu grzechów i po zmówieniu modlitwy pokutnej, Rosja przygarnie nas jednak pod swoje skrzydła.
I będziemy jednak mieli ropę z rabatem. A po chrust niech Niemcy i Anglicy do nas przyjeżdżają. Zbiórkę i załadunek oczywiście kupujący organizuje we własnym zakresie.
Slawomirski 30 MAJA 2022 17:51
Schizofrenia to NIE jest choroba mikrotubul (microtubules). To jest choroba nie tyle naszego „hardware”, co naszego „software”, czyli naszego „oprogramowania” a nie „sprzętu”. Ściślej jest to choroba naszego „systemu operacyjnego” czyli na znacznie wyższym, „niematerialnym” poziomie abstrakcji, używając analogii ludzkiego mózgu z komputerem. Jak wiadomo, współczesne komputery na ogół nie znają już pojęcia awarii procesora (mikroprocesora), ale znają, i to aż za dobrze, awarie oprogramowania. Mikrotubule są przecież prostej budowy, niemalże jak cep, czyli nie za bardzo jest w nich coś, co się może zepsuć, a programy użytkowe mają dziś nawet setki tysiecy instrukcji i jeszcze więcej po translacji i kompilacji na język maszyny i stąd też mają one aż tyle błędów, gdyż wraz ze stopniem komplikacji rośnie też prawdopodobieństwo awarii danego systemu, nawet jeśli jest on aż tak redundantny i tak odporny na błędy i zakłócenia, jak ludzki mózg.
Szalom!
Izydor Danken 3 CZERWCA 2022 8:52
Ciekawa przepowiednia. Uczmy się więc rosyjskiego?
@kalvarya
Kolejny biedak, ktorego nie stac na polska czcionke.
How about a fairy dust fart into your face so that your charm may grow exponentially. Hurry, offer ends soon.
Zełeński zaczyna przypominać dysponenta lotu do Smoleńska … Tak sobie myślę prywatnie … szkoda Ukraińców jako pasażerów … wierzy,że pas tam jest ale nie widzi … a wystarczy zawrócić do Mińska …
Aborygen3 CZERWCA 2022 9:03
Stań pod kościołem/zborem/meczetem/synagogą po mszy/nabożeństwie etc. Może uzbierasz na te polskie czcionki?
SŁOWIANIN STANISŁAW 3 CZERWCA 2022 9:06
D o b r e !
A PAK4 wciąż milczy, niemalże jak Dezerter…
@PAK4 spierał się ze mną kiedyś, że patogeny przeskakują obecnie rzadziej ze zwierzyny na ludzi, i że medycyna daje radę. Nie zgadza się z tym „The Indpenedent”, Monkeypox: Why the climate and biodiversity crises mean we can expect more viruses like it, pisząc w związku z przeskokiem Małpiej Ospy, że jednak zdarza się to coraz częściej, i że należy przygotować się na kolejne przeskoki, z powodu ocieplenia klimatu i zapaści zróżnicowania biologicznego (biodiversity). Medycyna sobie radzi, owszem, przynajmniej na razie i tylko w krajach bogatego Zachodu.
Tak przy okazji, wolę nie myśleć kto co wyprawiał z małpami, gdy ten wirus przeskoczył….
Konflikt na banderowskiej Ukrainie … śmiertelność jak to na tzw. wojnie … Tak sobie myślę prywatnie … nad Wisłą w czasie wojny z COVID zgony dochodziły do ponad 500 osób dziennie … z powodu zdemilitaryzowanej służby zdrowia … jaka jest definicja zbrodni na narodzie …
Unia stoi przy Ukrainie … Tak sobie myślę prywatnie … taka rekonstrukcja Stalingradu … w duchu banderyzacji tzw. zachodniej cywilizacji … choć na czas wizyt pisowskich dygnitarzy portrety banderowskich ojców narodu znikają z salonów …
Kaczyński o Tusku … Tusk o Putinie … Tak sobie myślę prywatnie … kiedy zaczną o bogu jako sprawcy ich czynów … wszak są dziećmi boga i na jego podobieństwo …
@ SŁOWIANIN STANISŁAW
„Tak sobie myślę prywatnie …”
Prywatnie na publicznym blogu???
Pomysl moze, czy nie mylisz „prywatnie” z „osobiscie”. JA sobie tak mysle…
Powinien powstać Trybunał do zbadania po 1945 roku zbrodni obcych wojsk na terytoriach suwerennych państw … Tak sobie myślę prywatnie … jest okazja rozliczyć naruszających mir domowy bez pukania … Israel ma przechlapane …
Prywatnie … czyli nie jestem trollem … Tak sobie myślę prywatnie … publiczny żle się kojarzy od burdelu począwszy … na szalecie skończywszy …
Herstoryk
3 CZERWCA 2022
9:27
Nie ma takiej opcji, by występująca endemicznie choroba w jakimś zapyziałym kącie Afryki, nagle objawiła się jednoczesnie w kilku krajach swiata.
Prawdopodobieństwo zerowe.
Za to spore, przeprowadzenia testu.
Żyjemy w świecie pełnym różnych świrów, ale z biegiem czasu ten ponury nastrój może opanować większość populacji.
Zdarzają się też przypadki budzące zdziwienie. Do Wrocławia przyjechała młoda Japonka z kraju kwitnącej wiśni aby pomagać dzieciom z Ukrainy. Ma ledwie 16 lat. Jak zamierza pomagać zapytał dziennikarz w telewizyjnym studio. Będę się z nimi bawić, odpowiedziała po angielsku.
Bywają różne przyczyny konfliktów. Ten na wschodzie wydaje się kuriozalny. Tak jak wiadomość w telefonie „Nie ma takiego numeru”, a przecież był bo po co byśmy dzwonili
SŁOWIANIN STANISŁAW
3 CZERWCA 2022 10:11
Jesli bóg istnieje, to jest on(a,o) i to z definicji, jako wszechmocny, wszechwiedzący i wszechobecny oraz wiecznym sprawcą wszystkich złych czynów – dawnych, obecnych i przyszłych.
3 CZERWCA 2022 10:53
Trollem jest tu niejaki mfizyk. A dom publiczny, czyli public house, w skrócie pub, to mi się dobrze kojarzy, np. z tym krzyżówkowym angielskim piwem na 3 litery.
ls42 3 CZERWCA 2022 11:29
W Japonii, jak widać, też idotek nie brakuje. Ciekawe, kto ją finansuje? Najpewniej CIA.
wiesiek59 3 CZERWCA 2022 11:27
Zerowe? Przecież przy dzisiejszych możliwościach logistycznych wojska i tzw. służb, to każdą bakterię czy wirusa można rozesłać na większość ludności świata w kilkadziesiąt godzin, np. jako pilny transport szczepionek albo innch medykamentów ew. żywności czy wody. Wystarczy zacząć od największych aglomeracji Azji, Ameryki, Afryki i Europy. Dalej to już pójdzie to już niejako samo. :-(
W związku z wydarzeniami na wschodzie, które absorbują światowe rządy i opinię publiczną, pojawiają się pytania o stanowisko naszego rządu.
Dzisiaj rano wypowiedział się minister Michał Dworczyk. Uważa on, że skoro my pomagamy Ukrainie, to Ukraińcy będą nam wdzięczni i nastąpi pogodzenie
ls42 3 CZERWCA 2022 11:48
Kolejny kretyn z POPiS-u.
Wystarczy puścić plotkę o zatrutym zbożu z Rosji … Tak sobie myślę prywatnie … taka zbożowa czarna Wołga …
@kalvarya01
> A PAK4 wciąż milczy, niemalże jak Dezerter…
Cóż, nie jestem Twoją zabawką, tylko człowiekiem z krwi i kości, który często albo musi, albo chce robić coś innego niż czytać komentarze i samemu komentować.
Zresztą, jak najfaniejszego życia realnego życzę z tego miejsca Dezerterowi 🙂
> Kosowo stało się „etnicznie” albańskie niedawno temu, jeszcze za Tito
1) Wgłębiałem się w to i nie było dla mnie jasne, czy dominująca zmiana demograficzna miała miejsce w XIX wieku, czy w XX. Wiele wskazuje, że w XIX-tym, ale piszący i mówiący są stronniczy i nie do końca mogę im ufać. Obszary sporów etnicznych dorabiają się swoich mitologii głoszonej przez zwaśnione narody.
2) Dla porównania, to kiedy ten Krym stał się rosyjski? Albo Ukraina? Powiesz może, że no cóż, od XVIII wieku ekspansja. No ale właśnie — ekspansja państwa, a niekoniecznie migracja ludności (bo przecież Rosjanie nie są „rdzenną ludnością Krymu”). Jeszcze w 1917, w Kijowie spontanicznie tworzono… Ukrainę właśnie, a nie Rosję. Przyszli bolszewicy i zaorali.
W każdym razie, w wielu miejscach „rosyjskość” Rosji jest świeżej daty, więc zupełnie nie rozumiem dlaczego tak cię świeża etniczność swędzi w przypadku Kosowa — gdyby tak ktoś przywrócił „rosyjskość” do etnicznych granic z XV wieku… Cóż, największe marzenie rusofobów.
> ktory chciał dać Panubogu świeczkę a Diabłu ogarek i tym samym nie zadowolił on nikogo.
Ekhm…
Gdyby się gospodarka nie zaczęła sypać, to może nie byłoby rozpadu państwa. I nie byłoby konfliktu serbsko-albańskiego w Kosowie.
Problem jednak z tym gdybaniem jest taki, że nie mamy paru „kontrolnych” Jugosławii w zbiorze z innymi warunkami początkowymi.
> Bunt w Donbasie przeciwko banderowcom był zaś tak samo odgórnie sterowany, jak bunty Chorwatów czy Słoweńców przeciwko Serbom.
Ależ one właśnie były buntami lokalnymi. A Zachód bardzo nie chciał przejmowania odpowiedzialności za kraje byłej Jugosławii.
> NATO i EU poparły użycie siły przez Madryt przeciwko Barcelonie
Ta „zachodnia” strona stoi na stanowisku integralności terytorium państwa. Dlatego tak długo wstrzymywali się z uznaniem Słowenii, Chorwacji czy Kosowa. Dlatego tak obstają przy „zjednoczonej” Bośni i Hercegowinie, choć kraj się rwie na szwach. Dlatego uznawali sprawę Czeczeni za wewnętrzną sprawę Rosji, nawet jeśli obrońcy praw człowieka byli wstrząśnięci.
To jednak nie oznacza, że NATO i UE zezwoliły na strzelanie do cywilów, czystki etniczne, itp. Co można porównać z zachowaniem Rosji na terenach okupowanych.
> I ta siła oznacza niekoniecznie zaraz bombardowanie Barcelony przez NATO, na wzór Belgradu.
Ale, zaraz, jeśli Barcelona jest Prisztiną, to Belgrad jest Madrytem. Ja już nie wiem, kto kogo ma Twoim zdaniem bombardować.
> Krwawo stłumione dążenia Basków do niepodległości i to, że do dziś Londyn krwawo tłumi dążenia Irlandczyków to są fakty.
Znowu: nie ma tu przesiedleń, czystek etnicznych itp.
Owszem, był taki przypadek jak z błogosławieństwem biskupów zbombardowano Basków gromadzących się na mszy w kościele. Bombardowanie Guerniki w 1937. Tak, wtedy frankiści w czasie wojny domowej brutalnie dławili dążenia wolnościowe Basków, z pomocą faszystów.
Ale to 1937, a nie współczesna Hiszpania.
Tak samo można dyskutować o dawnej brutalności polityki brytyjskiej w Irlandii, do ogłoszenia jej niepodległości włącznie.
Ale to wszystko stare dzieje. To co późniejsze i krwawe, to nie walka ze społeczeństwami i narodami, ale z organizacjami terrorystycznymi — ETA i IRA.
> Jeśli widzisz grzechy Zachodu, to dlaczego piszesz Acan tylko o grzechach Wschodu? Bo NIE jesteś obiektywny.
Bo pisać Wam o grzechach Zachodu, to jak dawać niegrzecznemu dziecku do ręki zapałki, w rafinerii ropy naftowej.
> Zimna wojna NIE skończyła się ponad 30 lat temu ale toczy sie ona wciąż miedzy USA i jego wasalami a Rosją i Chinami.
Właściwie to nie wiem od czego zacząć. Czy od tego, że Rosja i Chiny to nie jest jeden obóz, choćby dlatego, że Chiny sobie świetnie współpracują ze Stanami (OK, współpracowały) od czasów wizyty Nixona w Pekinie?
Czy może od tego, że przecież koło 1990 roku, wszyscy z sobą pięknie współpracowali przeciwko Saddamowi?
Owszem, Rosja chce odgrywać rolę bieguna i chciałaby by świat był dwubiegunowy. Cóż, dodaje to prestiżu, nagania też stadko wasali pod skrzydła Kremla. Ale jak przychodzi co do czego, to kto popiera Rosję? Gdzie ten „blok”? Gdzie ta wizja świata?
Wielkim brakiem Rosji jest to, że nie ma ona tzw. „miękkiej siły” — nie imponuje produkcjami filmowymi, jakimś własnym Netfliksem*; nie przyciąga najzdolniejszej młodzieży świata na swoje uniwersytety. Zresztą — Abramowicz kupił Chelsea, a czy jakiś Musk się odwzajemnił zakupem Zenita St. Petersburg?
W pewnych okresach „realny socjalizm” był jakąś alternatywą dla państw niezaangażowanych, tak samo jak uczelnie bloku wschodniego. Rosji w zasadzie zostało tylko w miarę nowoczesne uzbrojenie i grupa klientów-wasali, którzy liczą na czołgi, samoloty, śmigłowce. Grupka niewielka i niewiele warta.
*) Wyjaśnienie dla Wieśka — ja tu trochę ironizuję, ale to że z radia lecą piosenki z tekstem angielskim, a nie rosyjskim, ze dyskutuje się „Breaking Bad” a nie „Kamieńską” jest zauważalnym faktem.
> Szwecja i Szwajcaria stanęły de facto po stronie Hitlera, dopóki on zwyciężał.
I Szwecja i Szwajcaria zostały de facto okrążone przez siły osi.
Jako dziecko jeszcze czytałem historię zakupu i przewiezienia łożysk kulkowych ze Szwecji do Wielkiej Brytanii w czasie wojny. Cóż, to była awanturnicza przeprawa przez Cieśniny Duńskie opanowane przez lotnictwo i marynarkę III Rzeszy. Tak, że jak narzekasz, że handlowali z Rzeszą, a nie z Aliantami, to ja pytam, jakim szlakiem do jasnej [tu nazwa choroby epidemicznej], mieli sprzedawać stal, łożyska i maszyny Aliantom?
> Mowa była a o USA, UK, Francji, Izraelu a nie o pionkach typu Polski czy Australii.
Ja nie wiem, czy Francja albo Izrael są jakimiś super samodzielnie rozgrywającymi. Polskę zaś i Australię wymieniłem, bo to są „nasze” kraje. Optyka, gdy patrzymy na własny rząd i na własną, jako obywateli, odpowiedzialność jest inna, niż gdy zaczynamy rozmawiać o rządzie i odpowiedzialności obywateli krajów trzecich.
Nie ma wątpliwości, że arogancja Kolektywnego Zachodu jest podsycana przez ignorancję, która jest wynikiem niskiej jakości edukacji produkowanej przez ideologiczne instytucje, które Zachód nazywa uniwersytetami, które zostały przekształcone z miejsc rygorystycznej nauki w takie, które produkują wyłącznie egoistyczne egocentryczni, narcystyczni, hedonistyczni ideolodzy, którzy są niezdolni do jakiejkolwiek myśli poza JA!
Edukacja odzwierciedla mentalne nastawienie ludzi. Społeczeństwo, które nie uznaje ani zła, ani słuszności, prawdy ani fałszu, nie może wytworzyć prawych ludzi, którzy są w stanie poddać swoje myśli i czyny głębokim refleksjom i zastosować konieczne przerwy w celu powstrzymania zwierzęcych impulsów.
Od najmłodszych lat ludzie Zachodu są wychowywani do traktowania wszystkiego jako względnego i mieszania retoryki z czynami.
https://thesaker.is/its-education-stupid/
===========
Prawda w pigułce…..
I oni chcą zdominować Świat?
SŁOWIANIN STANISŁAW 3 CZERWCA 2022 11:53
Wystarczy puścić plotkę o zatrutym gazie z USA. ;-)
wiesiek59 3 CZERWCA 2022 12:04
Otóż to.
Zboże z Rosji krwawi … jak ropa i gaz … Tak sobie myślę prywatnie … coś wymyślą na podobieństwo kaszanki …
@mfizyk:
Ja to jakiś tydzień temu pisałem. Tak sobie myślę prywatnie u Stanisława robi za światła awaryjne, u kierowcy, który chce się zatrzymać na zakazie.
@Herstoryk:
Echm…
Zerknąłem. OK, piszą o czynnikach, które mogą pogorszyć sytuację epidemiczną — z tym się nie spieram.
Gdy uczyłem się w szkole rosyjskiego, kolega został wywołany do zreferowania czytanki o Moskwie. Po pierwszym zdaniu nauczyciel mu przerwał:
— Że Moskwa jest czerwona (kolega powiedział krasnaja, zamiast krasiwaja) to jeszcze mogę zrozumieć, ale jeśli jest większa (kolega przekręcił słowo duża), to trzeba powiedzieć od czego.
Ja przepraszam, że tak wyskakuję z anegdotką sprzed dziesięcioleci, ale mi się ta konieczność podania punktu odniesienia w przypadku porównania bardzo wbiła w pamięć.
Bo jeśli mówisz, że się sytuacja pogarsza, to ja przepraszam, ale pytam: względem czego?
Bo ja się z wszystkimi negatywnymi czynnikami zgadzam. Mam, na drugą nóżkę, tylko jeden argument — otóż empirycznie, ostatnie kilkadziesiąt lat oznaczało wyjątkowe zejście z częstotliwością epidemii. Wliczając AIDS* i COVID. Aż budziło to niepokój specjalistów, bo epidemie występowały rzadziej niż wskazywały ich modele. A to sugeruje, że mamy jakiś czynnik, czy czynniki, które działają na drugą stronę. Zapewne jest to kwestia większej higieny, ogólnej poprawy warunków życia, oraz rozwoju medycyny.
Bo gdy piszesz o wyrabianiu się medycyny w „bogatych państwach Zachodu”, to ja mam dwie uwagi.
Po pierwsze, medycyna jako wiedza, nie ma granic. Co odkryją Amerykanie, Francuzi, czy Niemcy, mogą poznać Kostarykańczycy, Wietnamczycy, czy Masajowie. Wolno im. Nawet płatność czasopism naukowych jest do obejścia**.
Po drugie, zapewne masz na myśli, że nie wszędzie medycyna jest dofinansowana, że leki są drogie, wykształcenie lekarzy kosztuje, brakuje ubezpieczeń społecznych, itp.? I znowu, jak z czynnikami środowiskowymi, ja się z tym mogę zgodzić, ale jaki mamy punkt odniesienia? Bo ja nie znam jakiejś historycznej chwili, kiedy to pierwotna ludzkość, uprzedziwszy eksploatację dóbr naturalnych, wypracowała skuteczną i powszechnie dostępną medycynę…
—
*) Nawiasem mówiąc, w przypadku AIDS choroba przeskoczyła z zabijanych przez myśliwych małp, na zranionych/zadrapanych myśliwych najprawdopodobniej. Jak bardzo jestem przeciwko polowaniom, to mogę sobie wyobrazić paskudniejsze relacje ludzi i zwierząt.
**) Ja czasem narzekam, że ta wiedza w medycynie nie jest tak rozwijana i ujawniana jak powinna, ale znowu, tak można dyskutować z kimś kto wie, jak to ma działać, a nie na forum, gdzie zaraz ktoś wpadnie z twierdzeniem, że to sztuka a nie nauka, albo że na wszystko ma rośliny w swoim ogródku.
***
Dobrego weekendu wszystkim 🙂
„Bywają różne przyczyny konfliktów. Ten na wschodzie wydaje się kuriozalny. Tak jak wiadomość w telefonie „Nie ma takiego numeru”, a przecież był bo po co byśmy dzwonili ”
…………..
„W Japonii, jak widać, też idotek nie brakuje. Ciekawe, kto ją finansuje? Najpewniej CIA. ”
…………….. ( …… ) ……….
Blog Szalonych Naukowców nie istnieje ( na pewno nie naukowców ) a przecież jest , bo po co rozmaite świry finansowane najpewniej przez (…) importowały by tu ponura japońską schizofrenię . Prywatnie świrom najpewniej wydaje się ze są wesołkami .
Wystarczy byc świrem na BSzN a ponury bo naukowy nastrój , pryska
Rosjanie w Donbasie i okolicy stanowią dla banderowców tarczę ochronną … Tak sobie myślę prywatnie … to inne okoliczności niż w totalnej Pustynnej Burzy …
Ps ( dla potrzebujących )
Po co dzwonimy pod numer którego nie ma ? Bo innego ” nie znamy ”
Tak samo jest z BSzN . Po co piszemy tu całymi dniami i po nocach rozmaite dyrdymały ?
Bo nie mamy nic innego do roboty
PAK4 3 CZERWCA 2022 11:54
Dla mnie jesteś zabawką, królikiem doświadczalnym (lab rat) i trollem internetowym, ale de gustibus… 😉
1) To się mogło zacząć wcześniej, ale nabrało tempa za Tito, na skutek działań wiadomych służb, które zawsze mieszały na Bałkanach. Tito był użyteczny dla Zachodu tylko wtedy, kiedy był on w konflikcie ze Stalinem. Rdzenną ludnością Krymu są zaś zapewne Chazarowie, ale nie tylko oni. Tak samo zresztą to nie Niemcy, a Słowianie Połabscy sa ludnością rdzenną byłego NRD, o czym świadczą choćby nazwy miast na tym obszarze. Faktem jest też, że Kosowo jest ruiną, upadłym państewkiem, które ma w miarę poprawne stosunki tylko z innym upadłym państewkiem, czyli z Albanią.
2) Zachód bardzo nie chciał przejmowania odpowiedzialności za kraje byłej Jugosławii, ale niektóre z nich ochoczo bombardował, popierając przy tym terrorystów, np. w Kosowie.
3) Zachód bardzo szybko uznał „niepodległość” Słowenii i Chorwacji oraz Kosowa. Zachód obstaje przy „zjednoczonej” Bośni i Hercegowinie, gdyż nie wiadomo, jak ją podzielić bez masowych wywózek ludności, na którą dziś Zachodu nie jest już stać.
4) Skąd wiesz, jak zachowuje się Rosja na terenach okupowanych? Byleś tam niedawno temu?
5) Zachód popiera Madryt, tak jak popiera on Prisztinę, a więc nie bedzie bombardować Madrytu, a tylko Barcelonę, jeśli głosi się ona stolicą niepodległej Katalonii.
6) Na obszarze Irlandii są przesiedlenia, religijne getta etc. Może nie na mocy dekretu, ale metodą uprzykrzania życia tym, którzy nie chcą się wyprowadzić do „swojego” getta. A okupacja Baskonii przez Hiszpanię i Francję jest faktem i sam tego doznałem, kiedy przesiadając się z pociągu do pociągu na granicy Baskonii, musiałem iść korytarzem wśród drutów kolczastych – czułem sie jak nowy więzień wkraczający przez bramę z napisem „Arbeit macht frei”. Na szczęście, jako Polaka, a więc kogoś z zewnątrz i niepodejrzanego o konszachty z ETA sprawdzono mnie dość pobieżnie. Następnym razem uratowała mnie tamże przed szczegółową kontrolą służbowa legitymacja wydana przez Ministerstwo Nauki Portugalii. Tak więc tam też trwa wojna, tyle że obecnie jest ona jakby „uśpiona”, ale w każdej chwili może się ona „obudzić”.
7) Dla okupantów ETA i IRA są organizacjami terrorystycznymi, tak samo jak była nią AK dla Niemców. Czyli że przyznajesz, że działasz nie w interesie ludzkości, a tylko w interesie kliki rządzącej dziś Zachodem.
8) Rosja i Chiny to nie jest dziś jeden obóz, ale jak podaje 2 czerwca 2022 o 05:00 pm „South China Morning Post” (Hong-Kong), to „Russia’s relationship with China ‘better than an alliance’” („Stosunki Rosji z Chinami są ‘lepsze niż sojusz’”). A wojna może być pomiędzy więcej niż dwoma wrogimi blokami.
9) Rosja ma tzw. „miękką siłę”, ale ona jest ona znana głównie na Wschodzie a nie na Zachodzie. Co np. wiesz o największym dziś producencie filmów na świecie? A to nie są już US of A. Przykładowo – Według danych UNESCO w 2006 roku w Nigerii powstały 872 filmy, czyniąc ten kraj drugim po Indiach największym producentem na świecie. USA też w zasadzie zostały tylko w miarę nowoczesne uzbrojenie i grupa klientów-wasali, którzy liczą na czołgi, samoloty, śmigłowce etc. Grupka to niewielka i niewiele warta – taka Polska, Arabia Saudyjska, Tajwan i Izrael.
10) I cóż z tego, że Szwecja i Szwajcaria zostały de facto okrążone przez siły osi. Polska czy Malta, też były tak okrążone, a jednak walczyły. Nie mówię, że Szwedzi powinni sprzedawać stal, łożyska i maszyny Aliantom, ale że NIE powinni tego sprzedawać Niemcom, podobnie jak Szwajcarzy nie powinni trzymać złota zrabowanego Żydom (wł. Chazarom) przez Niemców.
11) UK, Francja i Izrael mają realną silę militarną, w tym własną broń jądrową i środki jej przenoszenia. Polska czy Australia nie mają zaś nawet porządnej armii.
12) Władcy Arabii Saudyjskiej sa znacznie gorszymi satrapami niż Putin z Baćką i Kimem razem wzięci, ale ci Saudowie to są przecież nasze squrvysyny, a więc Biden ich popiera. Oto cała moralność tzw. Zachodu.
olborski 3 CZERWCA 2022 12:41
Idi w wiadomo co na Ukrainu.
PAK4 3 CZERWCA 2022 12:26
Ludzkość wypracowała właśnie w miarę skuteczną i powszechnie dostępną medycynę, ale skutek jest taki, że zginie ona niebawem z przeludnienia, a więc z braku czystej wody, zdrowej żywności i czystego powietrza, albo z powodu wojen o w/w dobra i tzw. Lebensraum.
kalvarya01
3 CZERWCA 2022
13:31
Za moment, walka o wodę może drastycznie zmienić geopolitykę.
Jedynymi jak na razie krajami które dysponują nadwyżkami, to Argentyna, Rosja, Kanada, Chile, Brazylia.
Odsalanie wody wymaga energii, więc przy duzych kosztach nie jest to dostępne dla każdego kraju.
Tak więc, ciekawe robią się nasze czasy coraz bardziej….
Powtarzam – Władcy Arabii Saudyjskiej sa znacznie gorszymi satrapami niż Putin z Baćką i Kimem razem wzięci, ale Saudowie to są przecież nasze squrvysyny, a więc Biden ich popiera. Oto cała moralność tzw. Zachodu. 🙁
„Powstanie bowiem naród przeciwko narodowi i królestwo przeciwko królestwu; w różnych miejscach nastaną głód, zarazy i trzęsienia ziemi”.
Słowa zapisane przez Mateusza w jego Ewangelii, rozdział 24, werset 7, kwiecień 33
https://thesaker.is/the-future-to-the-back/
============
I SŁOWO staje się ciałem….
wiesiek59 3 CZERWCA 2022 13:46
Tak, tyle że w Kanadzie, to te deficytowe dobra należą do Indian i Eskimosów, którzy zapewne wkrótce odłączą się od „biało-żółtej” Kanady.
wiesiek59 3 CZERWCA 2022 13:50
Jakbym Dezertera słuchał… 😉
kalvarya01
3 CZERWCA 2022
13:50
Trudno się zgodzić z twoim wnioskiem.
Rzady krajów arabskich utworzono siłą zaledwie 100 lat temu.
Ich powstanie było tworem GB i Francji.
Zaprojektowano je jako kraje wasalne.
Uwzgledniając przy tym specyfikę arabskiej kultury plemiennej.
Wyszło w sumie nieźle, biorąc pod uwagę poziom zycia nawet przeciętnego mieszkańca.
Tam rzeczywiście stosuje się maksymę- Bóg nakazal się dzielić…
Że odbiega to od wzorca narzucanego reszcie świata przez Zachód?
Wywołuje dysonans poznawczy?
Moim zdaniem, nie wszystkie cywilizacje musza być na jedno kopyto.
Anglosaskie na dodatek.
kalvarya01
3 CZERWCA 2022
13:55
U Sakera poruszane są bardzo różne tematy.
Z przyjemnoscią codziennie czytam teksty i bardzo wiele wnoszące komentarze pod nimi.
Na pewne tropy sam nigdy bym nie trafił.
Mając czas, mozna się wiele nauczyć.
wiesiek59 3 CZERWCA 2022 13:50
Jeszcze lepsza jest Apokalipsa według Św. Jana:
Część II – najciekawsza (4,1 – 22,5)
- wprowadzenie: wizja tronu, Baranka, zwoju (księgi) (4,1 – 5,14)
- siedem pieczęci (siódma pieczęć wchłania część po niej następującą) (6,1 – 7,17)
- siedem trąb (siódma trąba wchłania część po niej następującą) (8,1 – 11,14)
- znak Niewiasty, Smoka, aniołów z siedmioma plagami (siódma plaga wchłania część po niej następującą) (11,15 – 16,16)
- konkluzja – prezentacja „wielkiego dnia” ostatecznej interwencji Chrystusa (16,17 – 21,4)
W skrócie, zastępując Dezertera i za Wiki:
Jan opisuje wizję Boga zasiadającego na tronie czci oddawanej Mu przez 24 Starców i 4 Istoty żyjące oraz Baranka otwierającego „księgę zapisaną wewnątrz i na odwrocie”, zapieczętowaną na 7 pieczęci, których otwarcie wiązało się z wydarzeniami na ziemi (pojawienie się kolejno 4 jeźdźców Apokalipsy, widzenie dusz męczenników domagających się sprawiedliwości, trzęsienie ziemi połączone z zaczernieniem słońca, krwistą barwą księżyca, upadkiem gwiazd, ogólnym przewrotem w świecie materialnym). Po otwarciu siódmej pieczęci następuje wizja 7 trąb, których brzmienie również wiąże się z wydarzeniami światowymi (spalona ziemia, krwiste morze, zatrute źródła, zaćmienie ciał niebieskich, Abaddon z szarańczą, 200 milionów jeźdźców zabijających 1/3 ludzi). Po wybrzmieniu siódmej trąby ukazała się Niewiasta, która porodziła Syna i walka w niebie między Michałem i jego aniołami a Smokiem i jego aniołami. Smok przekazał władze bluźnierczej Bestii, na usługach której była inna Bestia, której imię jest 666. Po jej przejściowym triumfie następuje triumf tzw. Baranka, któremu towarzyszą 144 000, wizja żniwa i winobrania, otwarcia świątyni Przybytku Świadectwa i aniołów z 7 czaszami, których wylewanie powoduje 7 plag spadających na ludzkość (złośliwa rana w ciele sług bestii, krwiste morze, krwiste źródła i rzeki, wielki skwar, ciemność w królestwie bestii, wysuszenie wód Eufratu, trzęsienie ziemi i rozpad Babilonu na trzy części). Następnie Jan kreśli wizję upadku i zagłady Wielkiego Babilonu, ostatecznej walki Słowa Boga z Bestią, Sądu Ostatecznego i Miasta Bożego – Nowego Jeruzalem. Księgę wieńczy wyrażenie przekonania o rychłym powtórnym przyjściu Jezusa: „Mówi Ten, który o tym świadczy: ‘zaiste, przyjdę niebawem’. Amen. Przyjdź, Panie Jezu!” Ale że Jego NIE ma, a więc On nie przyjdzie…
3 CZERWCA 2022 13:58
Ja piszę tu tylko o Saudach, a nie o całym Islamie czy całym świecie arabskim.
Czycha na nas wiele pułapek, których istnienia w zwykłych czasach nie dostrzegamy, a przecież to pierwszy konflikt na europejskim kontynencie o lepsze jutro dla mieszkańców Ukrainy.
Weźmy pod uwagę, że nie jest to walka białych z czerwonymi, bogatych z biednymi, czy nawet chrześcijan z wyznawcami innej religii. Po prostu mieszkańcy Ukrainy zostali wplątani w cudzą wojnę i nie potrafią się odnaleźć.
Po co się bić do upadłego w sytuacji gdy można mieszkać w tym samym miejscu, pracować jak zwykle i żyć w spokoju.
Przecież powodem konfliktu było uspokojenie nastroju społecznego i wprowadzenie demokratycznych zasad pokojowego współistnienia z wyłączeniem nielicznych pogrobowców faszyzmu i nacjonalizmu.
Przez tyle powojennych lat było tam spokojnie, to zamiast budować przyjazne relacje z sąsiednimi państwami, chciano zdominować mniejszości, ograniczając ich niezbywalne prawa, wbrew europejskim traktatom przyjętym po wojnie i zamiast spokoju mamy wojnę w barbarzyńskim wydaniu.
Pominę starania polityków zza Oceanu podgrzewających i utrzymujących stan zagrożenia dla światowego pokoju.
PS. To miała być krótka odpowiedź szanownemu olborskiemu, ale chyba zbyt tym razem się rozwlekło
ls42 3 CZERWCA 2022 14:15
O Prześwięta Naiwności! Przecież tam NIE chodzi o lepsze jutro dla mieszkańców Ukrainy, a tylko o to czy Rosja czy też USA będą kontrolować tereny Małej Rusi, czyli inaczej Ukrainy. Ale zgoda co do reszty, gdyż Ukraińcy dali się oszukać zachodniej propagandzie i własnym banderowcom, czyli tamtejszym neo-nazistom i teraz mają to, czego chyba jednak nie chcieli.
Herstoryk 3 CZERWCA 2022 9:27
@PAK4 to klasyczny wręcz wykształciuch, typowy zwolennik PO i konformista – za Bieruta wychwalałby jednego Bolka, a za Wałęsy innego. On nie ma własnego zdania, on tylko powtarza to, co mu wiatr przyniesie – dziś z Zachodu, a dawniej ze Wschodu. Niestety, ale tacy ludzie dziś rządzą w Polsce i opanowali mass media, takie jak np. „Polityka”, ze zgubnymi skutkami dla Polski i Polaków.
Swoją drogą, to medycyna sobie z niczym nie radzi, nawet a szczególnie w krajach (do niedawna) bogatego Zachodu. Jedyne, w czym sobie radzi, to przyczynianie się do przeludnienia Ziemi.
@kalvarya01:
Niestety, nie rządzę w Polsce. I nigdy nie rządziłem. Nawet jako „popierający partię rządzącą” nie rządziłem. Co najwyżej jako traktujący takie PO jako mniejsze zło. Choć, z Waszego punktu widzenia, czy to szkoda? Nie tylko popieram Ukrainę, ale i jestem zwolennikiem umiarkowanie socjaldemokratycznego podejścia do gospodarki, przestawienia gospodarki na tory ekologiczne, praw dla osób LGBT, zwiększenia uprawnień UE i ONZ. Czyli totalne przeciwieństwo Waszego bożka — Andrieja Rajewskiego.
Ale:
> Zachód popiera Madryt, tak jak popiera on Prisztinę, a więc nie bedzie bombardować Madrytu, a tylko Barcelonę, jeśli głosi się ona stolicą niepodległej Katalonii.
Więc przynajmniej w jednym przypadku powinieneś Zachód poprzeć, by zachować logikę swoich wypowiedzi i przekonań, oraz dać się zrzucić jako bomba.
> USA też w zasadzie zostały tylko w miarę nowoczesne uzbrojenie
Używam komputera z Windowsem (made in USA), komórki z iOSem (made in USA). Tak pierwsze z brzegu.
> I cóż z tego, że Szwecja i Szwajcaria zostały de facto okrążone przez siły osi. Polska czy Malta, też były tak okrążone, a jednak walczyły.
Przypomnij mi, proszę, kiedy Polska zaatakowała Niemcy by wywrzeć pomstę za zbrodnie Hitlera? Albo kiedy wzburzona moralnie polityką Mussoliniego Malta wypowiedziała wojnę Osi?
> UK, Francja i Izrael mają realną silę militarną, w tym własną broń jądrową i środki jej przenoszenia.
No i?
Widzę u Ciebie któryś raz przykład nabożności przed atomem. Co możesz zrobić z bombą atomową? OK, niech będzie że z rakietą jako środkiem przenoszenia?
To znaczy możesz, owszem — możesz sprawić, że inni zrzucą ci swoją rakietę na głowę. Tyle możesz.
Broń atomowa jest bronią ostateczną — nie można jej użyć dla przechylenia szali walk w Ukrainie, na przykład; tak jak nie można jej było użyć, by zmusić Serbów do zachowania warunków układu i powstrzymać ich przed masakrą w Srebrenicy.
Więcej — dla Rosji to zapewne teraz bardziej obciążenie niż ratunek, bo utrzymanie broni atomowej kosztuje — a Rosja nie jest tak pragmatyczna jak Francja, Chiny, Wielka Brytania, Indie, Pakistan, czy Izrael — by mieć tyle ile trzeba i nie więcej.
> Władcy Arabii Saudyjskiej sa znacznie gorszymi satrapami niż Putin z Baćką
Pytałeś mnie o to, a ja pominąłem. Cóż…
Przypomnę tylko, że do niedawna z Putinem się spotykano. Macron do niego dzwonił, aż sobie dowcipkowano, że się zakochał. Przy całym odgrażaniu się co gorętszych głów wiadomo, że będzie trzeba z Rosją usiąść do stołu, a nawet że zapewne Ukraina będzie się musiała zrzec jakiejś części terytorium. Cóż, niesmak pozostanie.
Swoją drogą, na tym tle to Saudowie nikogo nie napadli i mają mniej ludzkiej śmierci na sumieniu niż Putin. Tak więc „gorszość” jest tu mocno względna. No, ale skoro popierasz interesy Saudów popierając wojnę Putina, to chyba Ci wszystko jedno.
Swoją drogą, na tym tle to Saudowie nikogo nie napadli i mają mniej ludzkiej śmierci na sumieniu niż Putin. Tak więc „gorszość” jest tu mocno względna. No, ale skoro popierasz interesy Saudów popierając wojnę Putina, to chyba Ci wszystko jedno.
========
Jemen….
Finansowanie Al-Kaidy.
Bojowek Wahabickich w Czeczenii, Jugosławii, Afryce, Syrii.
Prawdopodobnie, 9/11- współudział.
Generalnie, kraje arabskie są dla swoich OBYWATELI bardzo przyjazne.
Niespecjalnie dla ok 40 milionów gastaibarterów z Pakistany, Indii, Bangladeszu.
Bardzo nieprzyjazne dla uchodźców z róznych krajów.
Mówie tu o krajach Zatoki, oczywiście.
Syria czy Jordania , znacznie biedniejsze, robiły znacznie więcej dla swojej czy obcej populacji na swoim terenie.
Kluczem do zrozumienia wyrozumiałości wobec nich, jest petrodolar.
Bez kupowania za gigantyczne sumy papierów skarbowych, system się zawali.
Symptomatyczne jest też obecne działanie w kierunku większych kontaktów z Chinami i Rosją, przejście na krajowe waluty w cześci kontraktów.
Arabowie to przede wszystkim kupcy.
Zmiana kierunku wiatru powoduje zmianę kierunku politycznego.
Mają długą historię sprzymierzania się z aktualnymi zwycięzcami.
PRZED faktem zwycięstwa którejś ze stron.
Genialne wręcz wyczucie geopolityczne.
Nuclear Power Plant Project Anticipated in Saudi Arabia
http://www.businesskorea.co.kr/news/articleView.html?idxno=93914
Rząd Arabii Saudyjskiej wysłał w zeszłym tygodniu zapytanie w sprawie budowy dwóch elektrowni jądrowych o mocy 1,4 GW do Korei Południowej, Francji, Chin i Rosji, a wielkość projektu szacuje się na 12 bilionów wonów (ponad 9 mld USD).
===========
Saudowie MYSLĄ o przyszłości…..
@Wiesiek59:
11/9? OK, nawet policzmy Saudom.
Putin, tak pierwsze z brzegu:
Czeczenia II — ponad 25 tys. ofiar śmiertelnych.
Ukraina — kilkanaście tysięcy ofiar śmiertelnych.
Do tego 5 milionów uchodźców.
Przy tym kilka tysięcy ofiar 11 września, to zdecydowanie mniejsza liczba.
> Kluczem do zrozumienia wyrozumiałości wobec nich, jest petrodolar.
Ktoś z tym dyskutuje? Ktoś broni Saudów? Odnoszę się do porównania względnego, gdzie bliskowschodni fanatycy religijni, szerzący nietolerancyjną religię, czego ubocznym skutkiem mogłyby być zamachy terrorystyczne są przedstawiani jako gorsi, do euroazjatyckiego fanatyka, szerzącego wojny i dezinformację.
Zauważam tylko, że wobec Putina też świat jest bardzo wyrozumiały, jak dotąd, co wynika z petrodolarów i broni nuklearnej.
Stosujmy jedną miarę!
> Saudowie MYSLĄ o przyszłości…..
Tak. To spora różnica między nimi a Rosją.
wiesiek59 3 CZERWCA 2022 16:09
Tak jak napisałem do PAK4 -nie popieram, w odróżnieniu od PAK4, żadnej wojny, ani tej prowadzonej przez Rosję, czy też tych prowadzonych przez USA albo Izrael. Saudowie ostatnio napadli zresztą na Jemen.
3 CZERWCA 2022 16:19
Oni mogą myśleć o przyszłości, ale jeśli chcą mieć przyszłość, to muszą sami wybudować te reaktory. Inaczej, to nie mają oni przyszlosci, opierając się, tak jak dziś Polska, na importowanej technologii.
PAK4 3 CZERWCA 2022 16:34
Ty bronisz tu i Saudów i USA, które stoją za Saudami. Poza tym, to ile milionów ofiar mają na sumieniu USA, choćby w Wietnamie, Korei, Iraku, czy Afganistanie? W walkach prowadzonych przez USA tylko w tym stuleciu zginęło ponad 387 000 cywilów. Miliony ludzi żyjących w strefach działań wojennych prowadzonych przez USA również zostały przesiedlone przez amerykański reżim. Stany Zjednoczone, po 9/11 siłą przesiedliły także co najmniej 38 milionów ludzi z Afganistanu, Iraku, Pakistanu, Jemenu, Somalii, Filipin, Libii i Syrii.
Co tam Putin … warto podać dane o setkach tysięcy ofiar nawracania na chrześcijaństwo rdzennych mieszkańców terytoriów podbijanych z pomocą misjonarzy … jeśli nie milionów … Tak sobie myślę prywatnie … widocznie bóg tak chciał … w Afganistanie była misja … a na Ukrainie ? …
PAK4 – tym razem od końca:
Saudowie napadli ostatnio na Jemen i mają więcej ludzkiej śmierci na sumieniu niż Putin, tyle że o tym nie wolno mówić na tzw. Zachodzie. I ja NIE popieram żadnej wojny – ani rosyjskiej, ani amerykańskiej ani też izraelskiej. I nie atakuj „chochoła”, którego sam złożyłeś ze słomy i patyków. Bądź uczciwy przynajmniej w dyskusji.
@kalvarya01:
Jeśli żądasz od napadniętego by się poddał, to popierasz napaść.
Jeśli żądasz od postronnych, by nie pomagali napadniętemu, to popierasz napaść.
A jeśli napaść jest wojną, to popierasz wojnę.
Nie musisz dziękować za wyjaśnienie.
PS.
Kiedy to USA napadły na Koreę? Albo Pakistan? Albo Syrię?
@SŁOWIANIN STANISŁAW:
> setkach tysięcy ofiar nawracania na chrześcijaństwo rdzennych mieszkańców
Taka podpowiedź: jak umrzesz, to nie możesz dać się nawrócić. (No dobrze, historia świętych zna kilka przypadków 😀 )
Nawracanie, na masową skalę, nigdy nie miało na celu mordowania. Jeśli ludzie ginęli to z innych powodów — czasem bardzo źle świadczących o kolonistach, ale wciąż z innych.
Swoją drogą „setki tysięcy”, to, hm… tak może Wielki Głód dla porównania?
Wielki Głód to dzieło Gruzina i jego żydowskich pomagierów … potem wysłanych do powstającego Israela … jako syjoniści mieli wprawę do pacyfikowania Arabów … Tak sobie myślę prywatnie … dzisiaj stalinowska Gruzja wzorem banderowców dumna jest z wąsów Soso … fana Suliko …
Ciekawe zjawisko … po 24 lutego z banderowskiej przestrzeni publicznej zniknęli banderowscy patroni tryzubowego państwa … nawet we Lwowie rok upa przechodzi milczkiem … Tak sobie myślę prywatnie … zadeptać ślady nazizmu …
PAK4
3 CZERWCA 2022
16:34
Widzisz….
Czołowe demokracje świata zabijają milionami.
I to tylko z powodu swoich INTERESÓW.
Przy nich wszyscy tzw „despoci” , Rezimy” to niewinni jako lelija…..
Ten kto głosi szczytne hasła i sam ich nie przestrzega, jest kim?
Tu nie chodzi o przeciętnych, moralnych, praworzadnych, dobrych ludzi w wielu krajach.
Tu chodzi o tych, którzy nimi rzadzą, a sa amoralni, pokrętni, zdegenerowani, zapatrzeni jedynie we własne korzyści.
Zabijanie ludzi w oddalonych o tysiace mil krajach, kompletnie nie zagrażających w swej masie swojemu, w imię zysku, jest odrażające.
Bardziej rozumiem interesy Saudów dla których odpowiednie ustawienie relacji z sasiadami- nawet siłą- jest jedna z opcji politycznych.
Rozumiem na tej samej zasadzie Rosję.
Nie rozumiem Francji, czy USA- ojczyzn demokracji i humanizmu.
Perfidnego Albionu nie trzeba rozumieć, te typy tak maja od 1000 lat.
Turcja?
Państwo jako dodatek do wojska- od zawsze, realizuje własne interesy w sposób tradycyjny.
To samo Indie, Pakistan, Chiny- spory graniczne są normą.
Pak4
Naprawdę, jesteś tak niezorientowany w geopolityce, że aż przykro….
Pakistan właśnie przeszedł zmianę władzy, dzięki funduszom przeznaczonym na przekupienie SN.
Korea została zaatakowana przez USA i pomagierów w 1950 roku
Syria została zaatakowana przez bojówki finansowane przez USA, AS, Katar, ZEA, Turcję.
Obecnie cześć terytorium Syrii- pola roponośne jest okupowana przez oddziały amerykańskie.
Zorientuj się prosze choćby minimalnie w temacie….
Obecnie, oddziały amerykańskie dyslokowano do Somali.
Trzeba dolać oliwy do ognia, bo słabo się pali?
SŁOWIANIN STANISŁAW
3 CZERWCA 2022
17:01
Wielki Głód ma w zalezności od źródeł, wiele wytłumaczeń.
Występował jednocześnie na wielu terenach Rosji i w wielu krajach.
Również w USA.
Nieurodzaj był zdaje się nie lokalny, spowodowany czynnikiem ludzkim, ale globalny.
Kilka następnych lat natomiast, to gigantyczne zbiory.
O Wielkim Głodzie pisali uchodźcy ukraińscy.
Problem w tym, że większość z nich mieszkała na ukrainie należącej wówczas do Polski, nie ZSRR…
Czujesz ten propagandowy smrodek?
Inna wersja mówi, że w zamian za dostawy maszyn płatne w złocie, USA zażądało ze względu na nieurodzaj w Pensylwanii i kilku innych stanach, płatności w zbożu.
Jako spłat kredytów udzielonych na industrializację.
Tak więc wersji logicznych choć niekoniecznie prawdziwych może być co najmniej kilka.
W zalezności od koniunkturalnych interesów, można wybrac najbardziej nośną propagandowo.
https://forsal.pl/swiat/unia-europejska/artykuly/8434523,ke-uruchomila-platforme-internetowa-ktora-ma-pomoc-w-eksporcie-zboza-z-ukrainy.html
=======
Czymś za tę broń trzeba przecież zapłacić…..
A że ludzie będą głodni?
Przecież przywykli….
Właściciele agrokompleksów śpieszą się, by zrealizować własne zyski.
Głównie to zachodnie koncerny.
Los tubylców niewiele ich obchodzi.
Na dodatek, spekulanci mają w tym momencie raj.
Rzucając gigantyczne kwoty wytrzepane z powietrza na rynki zywności, surowców, dzięki transakcjom future, moga dowolnie podbijac ceny na rynku SPOT.
Globalnie, nie brakuje nosników energii, surowców, żywności.
Brakuje umiaru spekulantom, którzy aby zarobic sa w stanie unicestwić miliony ludzi skazując ich na głód.
Ci panowie od surfowania na kontraktach siedzą głównie w Londynie i NY.
Czy mają jakieś uczucia ludzkie?
Nie sadzę.
Ich panowie wymagają jedynie efektywności w odzieraniu z życia biedaków.
https://www.youtube.com/watch?v=j4TOUrxzd28
====
Czas na kolejny kostiumowy film spoza europejskiego nurtu.
Sporo obca kinematografia mówi o innych kulturach.
Przynajmniej dla mnie.
@ wiesiek59
Poniewaz jestes tak dobrze zorientowany, to powiedz mi dlaczego ZSRR padl, Rosja grzeznie a USA, Zachod, Chiny no i caly kapitalizm zyja dlugo i szczesliwie?
Ale juz teraz moge ci powiedziec, ze na ich koniec bedziesz czekal do swojej smierci. A pewno i kilka pokolen dluzej 🙂
W czasie stalinowskiego głodu na Kubaniu jadano suszony chleb z arbuzem … Tak sobie myślę prywatnie … Rosjanie byli ofiarami Gruzina … jako kułacy …
mfizyk
3 CZERWCA 2022
18:00
Gorbaczow był idealistą, naiwniakiem.
Wierzył w szlachetność Zachodu.
Jelcyn pijakiem, wyprzedającym kraj za grosze.
Poza tym, komunisci tak jak w Polsce, przestali wierzyć w ideę.
Stracili wolę walki o ideały.
Chcieli sie wzbogacić, wstąpic na zachodnie salony.
Wylądowali w przedpokoju, albo jako lokaje.
Zachodnie elity NIGDY nie uznaja Slowian za równych sobie.
Zbyt głeboko zakorzeniony jest w nich rasizm.
Poczucie wyższości.
Snobizm, hermetyczność.
Ma to w sumie sens.
150 lat dominacji nad resztą świata.
Jedynie 16 krajów z 200 nie udało sie podbić.
60 w pełni zhołdować.
Ale, wiekszość z tych niepokornych na pewien czas dalo się kupić, korumpując elity.
@wiesiek59:
> Naprawdę, jesteś tak niezorientowany w geopolityce, że aż przykro….
No sorry, ale to Ty przypisujesz wszystkie wojny, w które USA było zaangażowane ich winie. Niektórym byli winni, wielu — nie. Noale to trzeba wiedzieć i rozróżniać.
> Zorientuj się prosze choćby minimalnie w temacie….
Hm… to ja Cię poproszę o zorientowanie się — Andriej Rejewski, którego tu przyciągnąłeś pod bloga linkami, wyleciał z Czerwonego Krzyża pod zarzutem pracy dla rosyjskiego wywiadu. Był winny, czy nie. A jeśli nie, to dlaczego nie odwołał się do sądu pracy, tylko zaczął prowadzić proputinowski portal?
Półfinał w Roland Garros okazał się fatalny dla Alexandra Zvereva. W drugim secie meczu z Rafaelem Nadalem doznał bardzo bolesnej kontuzji skręcając prawą stopę, co skutkowało bolesnym upadkiem.
Nie wiadomo kiedy wróci do gry, a to przecież jeden z kandydatów do czołowego miejsca w rankingu ATP.
W ćwierćfinale Zverev po kapitalnym czterosetowym spotkaniu pokonał wschodzącą gwiazdę światowego tenisa 18-letniego Hiszpana Carlosa Alcaraza.
Wielkie współczucie dla zawodnika. Grał do chwili kontuzji rewelacyjnie
PS.
Dzień mi zrobiła ankieta u Korwina-Mikke, gdzie ku żalowi Korwina jedynie 18,7% biorących udział wolało rosyjską okupację od przynależności Polski do UE. Jak Wy sobie radzicie w takiej mniejszości?
PS.2.:
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiAFq8NCrWRVYWJ3MeM08Ldrobe3JMYG_hgkZ3OBnD0OYsnzWlQ6_GMEK7bkQWQcxeOjixWGuGLxcMiyBBvLLesxFquO122LPDETQrBuuC7-SODwagsj2gszro2_98vMr89NUTOu2Y-4g_26dp4k6zm1rxfWhOOV3KqhkmU1F5RIHYVs3tWpoVuSmCNnA/s720/284978494_552289353134578_8808435020010501013_n.jpeg
PAK4
3 CZERWCA 2022
18:47
Każdy ma własną prawdę.
Ja polegam na opiniach Pilgera, Hudsona, Hedgesa, Robertsa, Buchanana, Kissingera, Brzezińskiego, kilku innych powaznych moim zdaniem publicystow- byłych polityk czesto.
Ty mozesz miec inne autorytety.
Walą prawdę prosto z mostu, o co toczy się gra globalna.
Na pewno nie o pietruszkę, idee,
Koncepcja „Pełne spektrum dominacji” jest celem.
A dominacja mówi, jaki ma być porządek dziobania.
Przypuszczam, że pewne nazwiska, koncepcje, moga byc ci kompletnie obce.
Ale to oni byli i czesto sa architektami swiata w tórym zyjemy, bądź jego obiektywnymi recenzentami.
Zachód sieje w swiecie chaos.
I to powinno byc za wszelką cenę powstrzymane.
Niech dotrze do ciebie głębia przekazu.
„Władza deprawuje, władza absolutna deprawuje absolutnie..
Powierzenie władzy jednemu zdeprowawowanemu osrodkowi nad globem, to jest zly pomysł.
Musi być jakis ośrodek kontrolny, punkt odniesienia, konkurencja, PRZECIWWAGA.
Nawet pochodząca z innych kręgów kulturowych.
Dla koncepcji świata jednobiegunowego, zarzadzanego z jednego ośrodka decyzyjnego, poswiecono miliony ludzi.
Wątpię czy warto było.
Skruszenie kajdan politycznych, ideologicznych, zastapiono po postu kajdanami ekonomicznymi. Zniewolenie zastąpiło jedynie formę, nie treść.
PAK4 3 CZERWCA 2022 15:42
1. Nasze szczęście, że nie rządzisz w Polsce i nigdy w niej nie rządziłeś. I dlaczego popierasz Ukrainę – ten sztuczny powojenny twór amerykańskiego i rosyjskiego imperializmu, który od roku 1945 nielegalnie okupuje znaczną część Polski ze Lwowem na czele i którego wojska podczas II WŚ wymordowały setki tysięcy Polaków i Żydów? A to twoje poparcie dla banderowców, to podchodzi wręcz pod antysemityzm.
2. Jak sobie wyobrażasz to przestawienie gospodarki na tory ekologiczne? Czy mamy jeść szczaw z nasypów i zbierać chrust w gajach, aby garstka bogaczy dalej konsumowała „na pokaz”? I czy jesteś za prawami dla nekrofilów i zoofilów, skoro popierasz homoseksualistów płci wszelakich? Prawdziwy postępowiec, taki jak Ty, popiera bowiem przywileje dla LGBTQ+, czyli wszystkie zboczenia seksualne w ramach wolności, równości, braterstwa i siostrzerstwa. Czy wiesz, że zwiększenie uprawnień UE i ONZ oznaczałoby dyktat Niemiec w Europie i Chin na świecie? I co to jest to „Andriej Rajewski”? Postać z serialu „Satisfaktsiya 2005”? Dlaczego miałby on być moim idolem?
3. To twoja logika jest tu pokrętna, a ja nigdy nie popierałem zachodniego imperializmu. I zrzuć sie sam jako bomba, boś trąba. ;-)
4. Windows to przeżytek i wcale nie wymyślili go Amerykanie, a Żydzi (kto myśli inaczej, ten antysemita), Moj komputer jest made in EU a „komórka” made in China. Pewnie też nie wiesz, że Wojsko Polskie wkroczyło do Berlina w roku 1945. Ale teraz to jest tabu. A Malta odegrała kluczową rolę np. w otwarciu frontu południowego (inwazja Aliantów na Italię).
5. Nie nabożność, ale realistyczność. Bombę atomową można bowiem eksplodować i tym samym wygrać wojnę – przyklad twoi Panowie z USA contra Japonia.
6. Skąd wiesz, że to Serbowie ponoszą winę za masakrę w Srebrenicy, a nie np. Bośniacy? Utrzymanie broni atomowej kosztuje zresztą niewiele a Rosję stać jest na więcej, w odróżnieniu od zadłużonego po uszy Zachodu i Izraela. Poza tym, to jak się Putin zdenerwuje to jej użyje i co wtedy zrobi Zachód poza przesunięciem swych odchodów do gaci? Przecież każdy rząd zachodni, ktory użyje broni jądrowej, bedzie skończony, gdyż ona jest jeszcze mniej ekologiczna niż VW Golf z silnikiem Diesla.
7. Z każdym trzeba rozmawiać. Sanacyjne dupki nie chciały rozmawiać z Hitlerem, uwierzyły w fałszywe obietnice Londynu i Paryża a przez to zginęły niepotrzebnie miliony Polaków i nie tylko Polaków.
8. Oczywiście, że trzeba będzie usiąść do stołu z Rosją, a Ukraina będzie musiała się zrzec sporej części swego pierwotnego terytorium: Krym, Donbas, Odessa i całe wybrzeże czarnomorskie. Lwów powinien zaś wrócić do Polski, tak samo jak Wilno i Grodno.
9. Saudowie napadli ostatnio na Jemen i mają więcej ludzkiej śmierci na sumieniu niż Putin, tyle że o tym nie wolno mówić na tzw. Zachodzie. I ja NIE popieram żadnej wojny – ani rosyjskiej, ani amerykańskiej ani też izraelskiej. I nie atakuj „chochoła”, którego sam złożyłeś ze słomy i patyków. Bądź uczciwy przynajmniej w dyskusji.
wiesiek59 3 CZERWCA 2022 19:26
Racja!
wiesiek59 3 CZERWCA 2022 18:31
Racja!
PAK4 3 CZERWCA 2022 16:54
Kiedy to USA napadły na Koreę? W roku 1950.
Pakistan? 2004-2021 podczas tzw. wojny z terroryzmem USA dokonywały operacji specjalnych w różnych krajach, w tym w Afganistanie, Pakistanie, Jemenie i Somalii.
Syrię? 1949 i 1956-7 i 2012-17.
Także:
Covert United States involvement in regime change:
20th century
1948–1960s Italy
1949 Syrian coup d’état
1949–1953 Albania
1953 Iranian coup d’état
1954 Guatemalan coup d’état
1956–57 Syria crisis
1957–58 Indonesian rebellion
1959–2000 assassination attempts on Fidel Castro
1959 Cambodia, Bangkok Plot
1960 Congo coup d’état
1961 Cuba, Bay of Pigs Invasion
1961 Cuba, Operation Mongoose
1961 Dominican Republic
1963 South Vietnamese coup d’état
1964 Brazilian coup d’état
1965–66 Indonesia, Transition to the New Order
1966 Ghanaian coup d’état
1971 Bolivian coup d’état
1970–73 Chile
1976 Argentine coup d’état
1979 Salvadoran coup d’état
1979–89 Afghanistan, Operation Cyclone
1975–92 Angola, UNITA
1981–90 Nicaragua, Contras
1982 Chad
1996 Iraq coup attempt
21st century
2012–17 Syria
mfizyk 3 CZERWCA 2022 18:00
ZSRR padł na skutek nieudanych deform Gorbaczowa, agenta Zachodu. Rosja odnosi sukcesy, a USA znajdują się w głębokim kryzysie ekonomicznym, społecznym i moralnym. Rządzone przez komunistów Chiny są zaś de facto największą gospodarką świata, ale za cenę eksploatacji innych państw, tak jak kazda centrala każdego imperium. I gdzie masz dziś czysty kapitalizm? Może w Somalii. Ale tam też mieszają dziś USA.
PAK4 3 CZERWCA 2022 18:55
Tak, Kennedy zginął zastrzelony przez samotnego, przypadkowego osobnika, niepowiązanego z nikim i z niczym, po czym przypadkowo zginął, będąc pod opieką policji.
PAK4 3 CZERWCA 2022 18:54
Odkad to większość ma rację? Zapytaj się w ankiecie” „czy chcesz płacić wyższe czy niższe podatki?” Większość powie, że niższe. Zapytaj się w ankiecie „czy chcesz otrzymywać więcej od państwa?”. Większość powie, że tak.
@ wiesiek59
@ kalvarya01
„ZSRR padł na skutek nieudanych deform Gorbaczowa, agenta Zachodu.”
Zapomnieliscie jeszcze dodac, ze Putin dal sie przez USA wciagnac w wojne na Ukrainie na ktorej moze tylko stracic. Jest tez agentem Zachodu?
No i macie swoich winnych 😉 . Ale zadnego rozwiazania zagadki, zadnego planu jak wygrac z Zachodem. I tak trzymac 🙂
Zdarzało się, że podczas meczów piłki nożnej na boisko wbiegał kibic na golasa i starał się wzbudzić sensację, ale nie przypominam sobie takiego incydentu na meczach tenisa ziemnego.
W czasie trwającego trzeciego seta w półfinale Wielkiego Szlema w Paryżu pomiędzy Norwegiem i Chorwatem na kort dostała się młoda kobieta i przykuła kajdankami do siatki.
Aby uspokoić sytuację trzeba było sprowadzić zawodników do szatni, a dziewczynę uwolnić z kajdanek.
Po przerwie sprawozdawca powiedział, że na bluzce dziewczyna miała wydrukowaną liczbę 1028, czy też „zostało 1028”.
Cokolwiek to znaczy przekonamy się po dokładnym wyjaśnieniu sprawy.
We wcześniejszym meczu półfinałowym bolesnej kontuzji doznał zawodnik reprezentujący Niemcy Alexander Zverev „Sasza”.
Jak na jeden dzień w Paryżu to takie podwójne smutne zdarzenie
@kalvarya01:
@większość:
Prawie nigdy nie utożsamiam się z większością, ale wiem, że to niekomfortowe. Dlatego pytam, jak z Twoim komfortem, jako Polaka należącego do mniejszości spragnionej rosyjskiej okupacji.
@Korea, 1950, „zmiany reżimów”:
W Korei to północ zaatakowała południe. To jak z autem Gersdorf i wypadkiem — przejeżdżał obok, więc powiązany ze sprawą, więc Gersdorf winna.
Powiązanie ze „zmianą reżimów” jest bardzo okrągłe i plastyczne. Poproszę o lepsze, sprawdzalne kryterium „napaści”.
> Ukrainę – ten sztuczny powojenny twór amerykańskiego i rosyjskiego imperializmu
Rozumiem, że Andrzeja Potockiego zamordowali Amerykanie na spółkę z Rosjanami. Zapewne jako rewanż za śmierć McKinleya i Aleksandra II.
> I co to jest to „Andriej Rajewski”?
Szczerze mówiąc sam chciałbym wiedzieć. Wiem, że pod pseudonimem The Saker prowadzi bloga i portal internetowy, który cytowaliście tu w zachwytach. Sam twierdzi, że urodził się w Szwajcarii, że pracował dla szwajcarskiego wywiadu, a potem wyleciał z Czerwonego Krzyża pod zarzutem pracy dla rosyjskiego wywiadu. W międzyczasie napisał książkę o rosyjskich siłach pokojowych, wspólnie z generałem-rektorem wyższej rosyjskiej uczelni wojskowej. Teraz bazuje na Florydzie.
Jego poglądy są przeciwieństwem moich — absolutny wolny rynek i absolutny, konserwatywny zamordyzm; do tego szeruje propagandę Kremla. Coś jak rodzima Konfederacja.
> Windows to przeżytek i wcale nie wymyślili go Amerykanie, a Żydzi (kto myśli inaczej, ten antysemita)>/i>
OK, to teraz piszę z MacOSa — lepiej?
Tak, czy inaczej — USA mają, m.in., ogromny udział w produkcji oprogramowania; tak jak i w innych działach produkcji wymagającej bardzo rozwiniętej technologii i wysokiego udziału badań.
Ja wolałbym, by w tej roli występowała UE, do której mi bliżej; ale jeśli mówisz, że Stany to broń i Hollywood, no to sorry…
> Nie nabożność, ale realistyczność. Bombę atomową można bowiem eksplodować i tym samym wygrać wojnę – przyklad twoi Panowie z USA contra Japonia.
To już Stalin i rozbicie Armii Kwantuńskiej nie są przyczynami kapitulacji Japonii?
> Skąd wiesz, że to Serbowie ponoszą winę za masakrę w Srebrenicy, a nie np. Bośniacy?
Są świadkowie, a rzecz miała miejsce na Ziemi, więc nie spieramy się tu o wątpliwe i zaszumione odczyty z sondy Voyager.
> Przecież każdy rząd zachodni, ktory użyje broni jądrowej, bedzie skończony, gdyż ona jest jeszcze mniej ekologiczna niż VW Golf z silnikiem Diesla.
Hm… to ciekawe porównanie. Trzeba by te skutki odpowiednio policzyć 🙂 Bo wcale to nie jest takie oczywiste.
> uwierzyły w fałszywe obietnice Londynu i Paryża a przez to zginęły niepotrzebnie miliony Polaków i nie tylko Polaków.
Akurat Londyn i Paryż zrobiły co do nich należało. Że w umowie Polska miała się dłużej bronić, to nie ich wina. To polskiej historiografii przewróciła w głowie szybka klęska Francji w 1940, która rozgrzeszyła wszystkie przykłady niekompetencji i tchórzostwa z września 1939. Oczywiście, propagandzie PRL było to na rękę…
> Lwów powinien zaś wrócić do Polski, tak samo jak Wilno i Grodno.
Biedna Ukraina — nie dość, że musi oddać swoje ziemie, to najpierw powinna podbić Białoruś i Litwę, by zapewnić ziemie do zwrotu.
> Saudowie napadli ostatnio na Jemen
OK, doliczam Putinowi Gruzję.
> I ja NIE popieram żadnej wojny – ani rosyjskiej, ani amerykańskiej ani też izraelskiej.
Wybacz, chcesz by napadnięci się poddawali Rosji (ale nie Stanom, nie Wielkiej Brytanii, czy Hiszpanii) — coś jakbyś powiedział, że jesteś przeciwko każdemu gwałtowi, i dlatego kobiety nie mają prawa się bronić — nie ma obrony, to nie ma gwałtu. Załatwiony lepszy świat.
Ukraińcy wracają do domu … w zasadzie kobiety i dzieci … Tak sobie myślę prywatnie … goebbelsowska propaganda o gwałtach kobiet i dzieci nie robi już wrażenia … banderowska propaganda skazała na ucieczkę miliony osób … nie ma to jak na Rusi … słowiańska ziemia obiecana …
@PAK4
Jak to już Ci napisałem: jeśli rzeczywiście jesteś za prawami (czytaj przywilejami) dla LGBT, czyli skoro popierasz homoseksualistów płci wszelakich, to powinieneś być też za prawami (czytaj przywilejami) także, między innymi, dla nekrofilów i zoofilów. Prawdziwy postępawiec, taki jak Ty, popiera bowiem przywileje dla LGBTQ+, czyli dla osób praktykujących wszystkie zboczenia seksualne w ramach wolności, równości, braterstwa i siostrzerstwa (siostrzeństwa?) – po angielsku brotherhood and sisterhood. Przypominam, że prof. Hartman na sąsiednim blogu wzywał do legalizacji kazirodztwa, a więc powinieneś być też z prawami (czytaj przywilejami) dla kazirodców, szczególnie, że na postępowym a raczej postępawym Zachodzie działają przecież legalnie organizacje promujące legalizację pedofilii, np. Partia na rzecz Miłości Bliźniego, Wolności i Różnorodności (Partij voor Naastenliefde, Vrijheid & Diversiteit, w skrócie PNVD) – holenderska partia polityczna założona 31 maja 2006 roku przez Marthijna Uittenbogaarda. Co prawda w roku 2010 partia ta została rozwiązana, ale w roku 2020 wznowiła ona swoją działalność. Jej program to m.in,:
- Obniżenie wieku zgody z 16 do 12 lat, a w dalszym czasie całkowicie jego zniesienie.
- Legalizacja zoofilii, która zdaniem partii powinna być w pełni legalna, o ile nie wiąże się to z nadmiernym wyeksploatowaniem czy maltretowaniem zwierzęcia.
- Obniżenie wieku, w którym można występować w filmach pornograficznych oraz wykonywać zawód prostytutki, do 16 lat.
- Możliwość w pełni legalnego pojawiania się w miejscach publicznych nago.
- Legalizacja miękkich narkotyków dla osób od 12-go roku życia, a od 16 lat również twardych.
- Całkowity rozdział państwa od kościołów.
- Zlikwidowanie instytucji małżeństwa,
- Bezwzględny zakaz spożywania mięsa.
- Darmowe przejazdy koleją.
Ja, gdybym był takim postępawcem takim jak Ty, to dodałbym też postulat legalizacji nekrofilii, o ile nie wiąże się to z nadmiernym wyeksploatowaniem czy maltretowaniem trupa.
Ukłony
mfizyk 3 CZERWCA 2022 21:18
To jest fakt, że ZSRR „padł” na skutek nieudanych deform Gorbaczowa, agenta Zachodu. Breżniew o tym wiedział i dlatego nie próbował nawet cokolwiek reformować. Ale zgoda, że USA wciągnęły Putina w wojnę na Ukrainie, chcąc włączyć ją w struktury NATO, czyli paktu z definicji antyrosyjskiego. I nie ma potrzeby układania jakiegokolwiek planu, aby wygrać z Zachodem, gdyż on sam się, niejako „sam z siebie” rozlatuje, „pruje po szwach”. I kup sobie wreszcie te polskie czcionki!
Wkrótce, za jakiś czas, niebawem ma się rozpocząć kontratak, od jakiegoś czasu, czyli prawie od miesiąca informują media, tymczasem prawie wszystko idzie w odwrotnym kierunku i fala uchodźców się nie zmniejsza i wpływa do naszego kraju, skąd rozlewa się po świecie.
Od dawna też zapisane zostały w literaturze przepowiednie co miały się ziścić, ale jeszcze wiszą nad naszą głową.
Dopiero po minięciu czasu prowadzone są analizy co i dlaczego poszło nie tak jak zapowiadano.
Od 4 czerwca 1992 roku dzisiaj mija 30 lat. To pora wspomnień obalenia rządu Jana Olszewskiego. Jedni byli za, drudzy przeciw, ale nawet dzisiaj zdania są podzielone, bo jak mówią co ma być to będzie.
W Paryżu dzisiaj finał Wielkiego Szlema. O zwycięstwo w turnieju grają Polka i Amerykanka.
Początek o 15-tej
@kalvarya01:
> jeśli rzeczywiście jesteś za prawami (czytaj przywilejami) dla LGBT, czyli skoro popierasz homoseksualistów płci wszelakich, to powinieneś być też za prawami (czytaj przywilejami) także, między innymi, dla nekrofilów i zoofilów.
Chochoł.
Generalnie „nasza” strona uważa, że do seksu potrzebna jest świadoma zgoda obu stron, co eliminuje z tej listy gwałty, pedofilię, zoofilię, czy nekrofilię, jako uczestnicy nie wyrażają takiej zgody.
> Przypominam, że prof. Hartman na sąsiednim blogu wzywał do legalizacji kazirodztwa, a więc powinieneś być też z prawami (czytaj przywilejami) dla kazirodców
Główny problem z kazirodztwem, jaki ma „nasza” strona, to fakt, że często powiązania rodzinne są środkiem wywierania nacisku — nie miałbym nic przeciwko, gdyby połączyło się w parę rodzeństwo, przynajmniej przez jakiś czas żyjące osobno (a zwłaszcza: wychowujące się osobno); mam jednak przeciwko typowym przypadkom kazirodztwa (patrz: mormoni w USA), czyli wymuszaniu seksu na własnych dzieciach (w praktyce: ojcowie na córkach).
> Partia na rzecz Miłości Bliźniego, Wolności i Różnorodności (Partij voor Naastenliefde, Vrijheid & Diversiteit, w skrócie PNVD) – holenderska partia polityczna założona 31 maja 2006 roku przez Marthijna Uittenbogaarda.
Ilu ona ma członków? Jednego, czy dwóch?
Serio, ta partia latająca jako straszak po forach prawackich powstała jako prywatna prowokacja jednego człowieka, a nie żaden realny ruch polityczny. To już więcej piszących ma ten The Saker…
Wojna Koreańska ma całkowicie inną genezę.
Miały być ogłoszone wybory powszechne, które wygrałby Kim, powszechnie uważany za bohatera.
Ale, komunista w Korei?
Niedopuszczalne…
Rhee dysponował oddziałami paramilitarnymi wcześniej współpracującymi z Japończykami.
Został zachęcony do ataków na północ, terroryzmu.
Potem, poszło gładko….
Tę samą metodę zastosowano w Jugosławii i Gruzji.
Uzbrój jakąś grupę, mniejszość, i wyslij do walki o własne interesy.
Będziesz miał pretekst do ingerencji.
Afganistan obnażył słabe strony natowskiej formacji … Tak sobie myślę prywatnie … a miał być blitzkrieg …
PAK4 4 CZERWCA 2022 8:11
1. Znów używasz Waćpan nieuczciwego chwytu erystycznego, gdyż ja jestem przeciwko obecności w Polsce jakikolwiek obcych wojsk – czy to amerykańskich, czy niemieckich czy też rosyjskich. A ty Acan jesteś za de facto militarną okupacją Polski przez USA – formalnie w ramach NATO, ale każdy przedszkolak wie przecież, że NATO to są praktycznie tylko USA z niewielkimi przybudówkami typu UK, Francji czy Turcji.
2. Powtarzasz znów Waćpan kłamstwa zachodniej propagandy, że w Korei to północ zaatakowała południe.
3. Kierowanie zmianą reżimów jest rodzajem napaści, a najlepszy przykład to zamach Pinocheta dokonany w Chile przy pomocy CIA.
4. O którym Andrzeju Potockim piszesz Acan? Z których jest On Potockich?
5. Jeśli nie wiesz Waszmość, co to jest to „Andriej Rajewski”, to dlaczego się na niego Acan powołujesz? Poza tym, to gdzie i kiedy ja cytowałem z tego niejakiego Sakera? Znów więc bezcelnie kłamiesz Mocium Panie. Wstyd! Ponadto to ja jestem przeciwko kapitalizmowi a za pełnym uspołecznieniem kapitału, ale nie za jego nacjonalizacją na wzór bolszewicko-maoistowski.
6. Apple jest tylko dla gejów i lesbijek. 😉 Prawdziwi programiści używają zaś Linuxa. Ale tak, czy inaczej, to Indie mają dziś ogromny udział w produkcji oprogramowania czy filmów fabularnych. USA to są zaś dziś głównie broń i Hollywood, tyle, że produkcja nowoczesnej broni wymaga istnienia kilku dobrych wyższych uczelni typu MIT i kilku oaz nowoczesności w morzu zacofania, takich jak tzw. Dolina Krzemowa. Ale w zacofanej, przedwojennej Polsce też były takie oazy nowoczesności, np. niektóre dzielnice Warszawy czy Gdyni, ale to nie one decydowały o obliczu ówczesnej RP.
7. Stalin i rozbicie Armii Kwantuńskiej są bezpośrednimi przyczynami kapitulacji Japonii, ale zgoda – bez tych „bombek”, to te „żółtki” z wysepek w pobliżu Chin, broniłyby się jeszcze jakiś miesiąc dłużej.
8. Masz Acan na myśli Świadków Jehowy czy też może świadków lądowania UFO?
9. Przy obecnym stanie opinii publicznej na tzw. Zachodzie, to oczywiste jest, że każdy rząd zachodni, ktory użyje broni jądrowej, bedzie skończony, gdyż ona jest jeszcze mniej ekologiczna niż VW Golf z silnikiem Diesla.
10. Londyn i Paryż NIC praktycznie nie zrobiły, aby pomóc Polsce, ale to było wiadomo, że nic nie zrobią już w sierpniu roku 1939. Podobnie też USA nie zaryzykują konfrontacji nuklearnej z Rosją w sprawie Polski. Przynależność do NATO oznacza zresztą niższe a nie wyższe bezpieczeństwo dla Polski. Ale o tym, to obecna reżimowa polskojęzyczna propaganda już Waćpanu nie powie.
11. Lwów powinien zaś wrócić do Polski, tak samo jak Wilno i Grodno. I to nie wymaga przecież, aby Ukraina musiała podbić Białoruś i Litwę, aby zapewnić nam te ziemie do zwrotu. Polska powinna bowiem otrzymać te zagrabione nam w Jałcie ziemie nie tylko od Ukrainy, ale też od Litwy i Białorusi.
12. Kierowana przez Arabię Saudyjską koalicja wspierająca rząd Jemenu w wojnie domowej, którą ten prowadzi z rebeliantami Huti, przeprowadziła naloty na cele wojskowe w stolicy Jemenu, Sanie – informują saudyjskie media państwowe – https://www.rp.pl/konflikty-zbrojne/art19150401-jemen-koalicja-pod-wodza-arabii-saudyjskiej-zaatakowala-cele-w-stolicy. A Acan popierasz takie „interwencje”, ale tylko pod warunkiem, że to napada Zachód, a najlepiej USA, ew. jego sojusznicy typu Arabii Saudyjskiej czy Izraela. Gratuluję więc swoistej moralności. I daj sobie Mocium Panie spokój z kolejnym atakowaniem tego, tandetnego zresztą „chochoła” własnej roboty.
PAK4 4 CZERWCA 2022 8:11
wiesiek59 wyjaśnił już Ci, że Wojna Koreańska ma całkowicie inną genezę. Miały być ogłoszone wybory powszechne, które wygrałby Kim, powszechnie uważany za bohatera. Ale, komunista w Korei? Niedopuszczalne!
PAK4 4 CZERWCA 2022 8:52
A więc jesteś Acan przeciwko LGBTQ+. Wstyd! A fe!
Poza tym, to w przypadku kazirodztwa, pedofilii, zoofilii, czy nekrofilii, to uczestnicy wyrażają zawsze takową zgodę (trupy co prawda tylko milcząco). I jak jest powszechnie wiadomo, to dzieci same księżom wchodzą do łóżek, bowiem ksiądz to jest przecież osoba święta, niemalże jak sam Panbóg.
Co zaś do argumentu ad ilość członków – NSADAP też zaczynała od kilku piwoszy monachijskich. Podobnie np. gauliści, którzy na początku mieli tylko de Gaulle’a, ale późnej dekadami rządzili Francją. Chrześcijaństwo też zaczęło się od jednego zbuntowanego rabina, jego mamy i taty oraz osiołka. etc. etc.
Szalom!
PAK4 4 CZERWCA 2022 8:52
Rozumiem, że jesteś Acan przeciwko takim postulatom PNVD, jak np.:
– Legalizacja miękkich narkotyków dla osób od 12-go roku życia, a od 16 lat również twardych.
- Całkowity rozdział państwa od kościołów.
- Zlikwidowanie instytucji małżeństwa.
- Bezwzględny zakaz spożywania mięsa.
- Darmowe przejazdy koleją.
Kiedy historia niewolnictwa w USA trafi na ekrany … Tak sobie myślę prywatnie … pod hasłem: Człowiek człowiekowi … panem …
SŁOWIANIN STANISŁAW 4 CZERWCA 2022 10:14
To już było, np. ‚Korzenie’ (ang. ‚Roots’), czyli miniserial telewizyjny, produkcji amerykańskiej; ekranizacja powieści Alexa Haleya, wyprodukowany przez Warner Bros., nadawany przez sieć ABC w roku 1977. Opowiada on o korzeniach i losach tzw. afroamerykańskich mieszkańców USA, przedstawiający sagę czarnoskórej rodziny amerykańskiej na tle historii kraju. Protoplasta rodu, niejaki Kunta Kinte (LeVar Burton), urodzony w Gambii, zostaje jako 15-letni młodzieniec schwytany przez handlarzy niewolników i zabrany do Stanów Zjednoczonych. Mężczyzna musi stawić czoła wielu przeciwnościom. Ocenia się, że serial zgromadził trzecią co do wielkości widownię w historii amerykańskiej telewizji. Wielokrotnie nominowany i nagradzany, m.in.: 9 nagrodami Emmy i 1 nagrodą Złoty Glob. (Wiki).
Ale niczego to w USA nie zmieniło.
@ kalvarya01
4 CZERWCA 2022
8:49
Zgadzasz sie, ze Putin to agent Zaschodu?? A moze tylko pozyteczny idiota Zachodu?
Co do waszego upragnionego (i wiecznie wyczekiwanego) upadku Zachodu i kapitalizmu: Nadzieja umiera jako ostatnia, itd. 🙂
Jeżeli tzw. Zachód jest bez grzechu niech pierwszy rzuci kamieniem … Tak sobie myślę prywatnie … sprawdzam … !
mfizyk
4 CZERWCA 2022
10:44
Nieoceniony prof. Hudson, wyjasni ci dokładnie, w jakiej sytuacji obecnie znajduje się Zachód, i jego poziom życia.
Ucz się chłopie.
https://thesaker.is/michael-hudson-interview-with-the-newly-founded-german-magazine-vier/
Gdyby religie były pokojowe nie byłoby wojen … Tak sobie myślę prywatnie … tzw. zachodnia cywilizacja wyciera sobie polityczną gębę bogiem … i mamy co mamy … ręka na sercu jak białostocki salut …
@ wiesiek59
4 CZERWCA 2022
12:56
Bardzo sie ciesze, ze wy sie tak intensywnie zajmujecie Zachodem i jego bledami. Bo Zachod sie na swoich bledach uczy. I to na pewno lepiej niz wy i wasi idole.
I to jest powodem, ze Zachod wygral z ZSRR i wygra z Rosja… Tak sobie mysle prywatnie na publicznym blogu …
Zachod (elity i spoleczenstwa) chetnie zajmuja sie wlasnymi bledami, bo chca sie z nich nauczyc. Zachod mniej mowi o osiagnieciach. Bo te mowia same za siebie.
Wy, wasi ideologowie i idole robia akurat na odwrot. Duzo mowicie o osiagnieciach (szczegolnie jezeli ich nie ma). A bledy sa przemilczane. Bo wasza ideologia jest bezbledna 😉 A jak ktos z waszych popelni blad, to jest agentem Zachodu 😉 Wiec nie macie szans sie z bledow czegos nauczyc.
My na Zachodzie tez dzieki waszej krytyce sie uczymy i wygrywamy 🙂 I nawet jezeli to rozumiecie, to i tak bedziecie nas przez wasza krytyke wspomagac. Bo tak juz macie 🙂
Is42
Spokojne życie tylko w spalonym i zbombardowanym domu ( nie zna życia komu go nie zbombardowano )
…………………….
„Po prostu mieszkańcy Ukrainy zostali wplątani w cudzą wojnę i nie potrafią się odnaleźć.
Po co się bić do upadłego w sytuacji gdy można mieszkać w tym samym miejscu, pracować jak zwykle i żyć w spokoju. ”
……………………………
Za to mieszkańcy Rosji znakomicie odnajdują się we własnej wojnie na terenie sąsiedniego kraju , co zawsze było ich specjalnością i dobrze wychodziło im gwałcenie kobiet i ich dzieci , kradzenie czego popadnie .
Około trzech milionów tych kobiet z dziećmi pogubiło się we własnym kraju i rozpatrywaniu co jest dla nich lepsze . Patrzeć jak zabijane są ich dzieci i mężowie czy tez odnaleźć się w Polsce . Drugie takie rozpatrywanie , czekać czy uciekać z Polski może byc już dla nich za trudne .
Widać wyraźnie , ze tematy cudzych i swoich ( własnych ) wojen na własnych terenach są wyraźnie dla ciebie szanownego za trudne . Cudze u siebie staje się szybko twoje ale tylko (?) w czasie wojny .
Może powinieneś zając się cudzym królewskim jubileuszem i ciosami poniżej pasa ( tnp w co ?)serwowanymi kobietom ?( przez kobiety ) ?
Co kobiety maja ponizej pasa ?
………………
„”Kim Kardashian nie mogła dostać się na jubileusz Elżbiety II. Dla celebrytki to cios poniżej pasa ” „
Dlaczego Rosjanie mają zabijać Rosjan w Donbasie skoro mają ich wyzwolić z banderowskiego reżimu … Tak sobie myślę prywatnie … powroty Ukraińców do kraju przeczą propagandzie Zełenskiego … już ponad 2 mln …
mfizyk
4 CZERWCA 2022
13:25
Zachód jest pasożytem, wysysającym krew z 7/8 swiata.
Dlatego poświęcam mu wiele uwagi.
Neokolonializm jeszcze się dla wielu krajów ze skorumpowanymi elitami nie skończył.
Dotychczas nie było żadnej alternatywy dla takiego układu.
Obecnie powstaje.
Końcem zachodu będzie powstanie w szerszej skali nowego porzadku finansowego świata.
To kwestia kilku lat zaledwie.
A katalizatorem jest konflikt ukraiński i bezprecedensowa grabież aktywów finansowych zdeponowanych w zachodnich bankach.
Naruszona została ŚWIĘTOŚĆ- bezpieczeństwo depozytów bankowych.
Efekty nietrudno przewidzieć.
Patrząc na elity z perspektywy tych kilku tysięcy lat, nietrudno dojść do wniosku że wielokrotnie były zgubą dla swoich narodów.
Dzięki degeneracji, ślepocie, pysze, walkom o władzę, osłabiały państwo, czyniąc je podatnym na ciosy.
Zachodnie elity krocza własnie tą drogą.
Jak zwykle, pycha i zaslepienie kroczy przed upadkiem.
„Żelazne prawo oligarchii” się kłania.
10 przykazań z pierwszeństwem przed świeckim prawem … a tam: Nie zabijaj … Tak sobie myślę prywatnie … w krajach chrześcijańskich i nie tylko wojsko to grzeszny wynalazek … a mundur nie jest sutanną …
@kalvarya01:
> Znów używasz Waćpan nieuczciwego chwytu erystycznego, gdyż ja jestem przeciwko obecności w Polsce jakikolwiek obcych wojsk – czy to amerykańskich, czy niemieckich czy też rosyjskich.
Ironizuję sobie, bo podobne rzeczy twierdzący Korwin dał swoim zwolennikom taki wybór. No i 18,7% odpowiedziało, że chce być pod okupacja rosyjską. Ciekawe jak byś odpowiedział mając taki binarny wybór: NATO + UE, czy Rosja i jej armia?
> Powtarzasz znów Waćpan kłamstwa zachodniej propagandy, że w Korei to północ zaatakowała południe.
Zaktualizuj informacje o Ziemi na swojej planecie.
> O którym Andrzeju Potockim piszesz Acan?
O Andrzeju Kazimierzu Potockim, namiestniku Galicji.
> Jeśli nie wiesz Waszmość, co to jest to „Andriej Rajewski”, to dlaczego się na niego Acan powołujesz?
6 razy cytował jego portal (choć nie tylko go osobiście) Wiesiek; plus raz odwołał się z dedykacją dla Ciebie.
> Ale tak, czy inaczej, to Indie mają dziś ogromny udział w produkcji oprogramowania czy filmów fabularnych.
Filmów — owszem.
Indie są bardzo chwalone za szeroki sektor IT, tyle że to zwykle zlokalizowane w Indiach centrale doradztwa technicznego dla klientów, a nie centra wytwórcze.
Generalnie zarabiasz na produktach tym więcej, im więcej tam myśli technologicznej. I Stany nie imponują wielkością produkcji, ale imponują tymi zyskami płynącymi z przewagi technologicznej.
> Przy obecnym stanie opinii publicznej na tzw. Zachodzie, to oczywiste jest, że każdy rząd zachodni, ktory użyje broni jądrowej, bedzie skończony, gdyż ona jest jeszcze mniej ekologiczna niż VW Golf z silnikiem Diesla.
Co Ty z tym Golfem? Samochód jak samochód…
Nad ekologicznym efektem broni jądrowej musiałbym się poważnie zastanowić. Bo, o ile się nie jest Koreą Północną, to raczej się pracuje nad tym, jak zrobić broń, która zabije ludzi (i zwierzęta), ale pozostawi teren nieskażony, tak by można było teren okupować bez problemów. Takie brudne bomby, jak na Nagasaki i Hiroshimę, to już historia.
Problem z bronią atomową to nie problem z protestami ekologów, ale z tym, że jest to broń ostateczna — albo nie ma sensu jej użyć, albo jej używszy sprowadzasz na siebie atomowy kontratak. I już nie ma komu protestować, ani komu przyjmować paradę zwycięzców.
> Londyn i Paryż NIC praktycznie nie zrobiły, aby pomóc Polsce, ale to było wiadomo, że nic nie zrobią już w sierpniu roku 1939.
Wypowiedziały wojnę, którą w końcu Alianci wygrali, tak nieśmiało przypomnę. I zapłaciły za to niemałą daninę krwi. Ja sobie nie przypomina, by Polska zrobiła coś podobnego dla jakiegokolwiek innego kraju w historii.
Umowa Polski z Anglią i Francją obejmowała akcje aliantów w odpowiedzi na niemiecki atak, kilka tygodni po jego wystąpieniu, przy wyliczeniu, że Polska się wciąż broni. Tymczasem Niemcy zaczęli wycofywać co wartościowsze oddziały z Polski ok. 14 września, gdyż nie miały z kim walczyć; i kierować je na front zachodni. Francja i tak próbowała przyspieszyć ofensywę, ale Polska wcześniej upadła.
> A Acan popierasz takie „interwencje”, ale tylko pod warunkiem
Popieram obronę, czasem nawet warunkowo — jeśli ma ona szansę na zwycięstwo, a nie tylko na zadanie strat w trybie terrorystycznym.
Ten wątek zaczął się od porównania zbrodniczości Putina do zbrodniczości Saudów i był efektem mojego zwątpienia, że to Saudowie są gorsi. No właśnie, że niekoniecznie, a raczej nawet nie. Putin się w „zbrodniczości” rozkręca, gdy Saudowie trzymają podobny poziom.
> Co zaś do argumentu ad ilość członków – NSADAP też zaczynała od kilku piwoszy monachijskich.
1) PNVD powstała dla beki i kpin, nie na serio.
2) Pogląd lewicowo-liberalny na wolność w życiu prywatnym, w tym na ekspresję własnej seksualności poza heteronormatywnością jest wyraźny, oparty na jasnych przesłankach — póki nie robisz komuś krzywdy, a wszystko jest za świadomą zgodą, to jest OK. Te całe nekrofilie i pedofilie podpinane pod temat to fantazje prawaków, nie mające nic wspólnego z rzeczywistością.
Tak mi przypominasz jak kiedyś czytałem „Protokoły mędrców Syjonu”. Żeby uwierzyć w taką fałszywkę trzeba było mieć nieźle zakuty łeb, ale właśnie odpowiadała ona na lęki ówczesnej prawicy — i ta prawica uwierzyła. Dokładnie jak dzisiaj straszenie LGBT, ekologizmem, czy neomarksizmem.
@Stanisławie:
Mam chwilowy przypływ dobrego humoru (ciekawe, czy Iga go podtrzyma ;D ), to wyjaśnię o co chodzi w przykazaniach, bo to akurat nieźle rozczytałem:
Otóż, przykazania znamy w wersji nieco hm… przekręconej, a raczej przeinterpretowanej.
I tak:
1/1 – Nie będziesz miał bogów przede mną — ewidentnie resztka politeizmu, przynajmniej w myśleniu.
2 – W wersji judaistycznej, lub protestanckiej to osobno wyróżniony zakaz wykonywania rzeźb Boga. (Nawet prawosławni to częściowo zachowali, bo u nich wolno oddawać część obrazom, ale tylko dlatego, że są płaskie.)
2 – katolickie / 3 judaistyczne+protestanckie — zakaz nadużywania imienia Boga, w oryginale — zakaz fałszywego i pochopnego przysięgania na Boga z Jego imieniem; stopniowo ewoluujące w stronę zakazu używania Imienia w ogóle.
3/4 -pamiętaj o szabacie, chyba nie mam co przypominać, choć w sumie to dziś — tak, że ten, tego, maksymalna droga to 900 metrów z kawałkiem — trzeba siedzieć na fotelu i czytać Torę 🙂 no ewentualnie grillować dla miłego zapachu dla Boga…
4/5 – czcij ojca i matkę – przykazanie o tyle ciekawe, że w swojej redakcji nawiązujące do dobrobytu, co może wskazywać na dawne pochodzenie (dobry stosunek do rodziców, opieka nad nimi, upoważniały do przejęcia spadku po nich).
5/6 — nie morduj. Tam dokładnie to pisze — nie morduj, czyli nie zabijaj innych ludzi z przemocą, w sposób niezgodny z prawem… Ech, długie rozwinięcie, w każdym razie wojna, czy kara (oryginalnie) śmierci są dozwolone. Zresztą aborcja oryginalnie też nie jest objęta.
6/7 – nie cudzołóż, innymi słowy, nie można uprawiać seksu z mężatkami (poza własną żoną); z pannami wolno, choć seks z panną może być równoznaczny ze ślubem — tak że różnica nie jest aż tak głęboka. I ciekawostka — o ile Biblia potępia homoseksualizm, o tyle nie mówi nic o przypadku lesbijek; tak samo jak nie mówi nic o tym, ile osób na raz może seksualnie baraszkować…
7/8 – nie kradnij, choć niektórzy sugerują, że tu chodzi bardziej o kidnaping, niż kradzież, że kradzież pojawia się dalej.
8/9 – nie zeznawaj fałszywie — jak wyżej, mamy tu zakaz w sytuacjach prawnych, a nie kłamstwo w ogóle (choć to trochę dyskusyjne, bo w stosunkowo małej społeczności prawie wszystko może nabrać cech wypowiedzi o konsekwencjach prawnych).
9-10/10 — nie pożądaj żony bliźniego, ani żadnej jego rzeczy — wskazuje się, że generalnie Dekalog nie dotyczył złych myśli, tylko czynów, a pożądanie jest myślą, więc może chodzi o przypadek gdy myśl zamienia się w czyn. Tak lubią tłumaczyć zwolennicy umieszczenia w przykazaniu 7/8 kidnapingu — tu znalazłaby się wtedy kradzież.
mfizyk 4 CZERWCA 2022 10:44
Pomylił ci się, biedaku, Gorbaczow z Putinem. Odstawiłeś lekaratwa czy też nie jest ciebie stać na nie?
Szalom, anyway
PAK4
W biblistyce jesteś niekwestionowanym autorytetem….
W innych dziedzinach, niekoniecznie.
Zabrakło szasu na studiowanie polityki różnych krajów?
======
Jak wyjasnisz zwyczaj porywania panien młodych w wielu kulturach?
Tyczy to miedzy innymi dawnych zwyczajów japońskich, kaukaskich, chyba równiez arabskich.
Formalnie, nie dostarczano posagu panny młodej, nie kupowano za jakieś stado, tylko porywano- za pełną zreszta zgodą starszych.
Geneza zwyczaju byłaby ciekawa.
No i Romeo i Julia byliby zywi….
PAK4 4 CZERWCA 2022 14:47
A tu ciekawa interpretacja Dekalogu, ale że teraz jest Szabas, to odpowiem Ci jutro, albo nawet i dziś, ale po zachodzie Słońca, jeśli Allach pozwoli (Allach to imię Wiadomo Kogo po arabsku i nie oznacza jego użycie tego, że jestem muzułmaninem).
Szalom!
Wiesiek59 4 CZERWCA 2022 12:56
Obawiam się, że to przekracza myślowe horyzonty i możliwości naszego PAK4.;-)
wiesiek59 4 CZERWCA 2022 13:48
Racja – tzw. Zachód jest pasożytem, wysysającym krew z 7/8 świata a neokolonializm jeszcze się dla wielu krajów ze skorumpowanymi elitami nie skończył. I zgoda, że dotychczas nie było żadnej praktycznej alternatywy dla takiego układu, ale ona obecnie powstaje i że końcem Zachodu będzie powstanie w szerszej skali nowego porządku finansowego świata, a to jest dziś kwestia już tylko kilku lat zaledwie.
Katalizatorem jest tu bowiem konflikt ukraiński i bezprecedensowa grabież aktywów finansowych zdeponowanych w zachodnich bankach. Naruszona została w ten sposób ŚWIĘTOŚĆ kapitalizmu nr 1, czyli bezpieczeństwo depozytów bankowych, a więc efekty tego nietrudno jest przewidzieć.
kalvarya01
4 CZERWCA 2022
15:21
Nie bądź agresywny, nieś ka-ganek oświaty pod strzechy….
I ich nie podpalaj przypadkowo….
Problem z mysleniem zdroworozsądkowym, moim zdaniem polega na tym, że brak fundamentów w postaci znajomości faktów, poznania przekazu antagonistów, wypierania wiedzy niezgodnej z „kosz-erną” wersją.
Samodzielne myslenie wymaga samodzielnej pracy.
A ta czasu, którego hedonistyczne mrówki zabiegające o wyższy standard materialny nie mają.
„Rosji „kończą się prezerwatywy””
Jak na ironię, w Wielkiej Brytanii może zabraknąć prezerwatyw, jeśli USA/NATO nałożą więcej sankcji na Chiny. Ostatnia fabryka Durex w Wielkiej Brytanii została zamknięta w 2007 roku i prawie wszystkie produkty Durex są obecnie produkowane w Guangzhou.
Wysłane przez: T Paine | 4 czerwca 2022 0:05 utc | 230
========
Z ciekawostek…..
mfizyk 4 CZERWCA 2022 13:25
Zachód popełnia ciągle te same błędy, np. USA wysyła znów wojska do Somalii, mimo iż poprzednio, to skończyło się na tym, że w roku 1993, do stolicy Somalii czyli Mogadiszu, zostały wysłane z USA ‘elitarne’ oddziały bandytów z Delty, Task Force 160 i tzw. Rangersów. Akcja zaplanowana była na maksymalnie 30 minut, ale po zestrzeleniu dwóch śmigłowców UH-60 Black Hawk przez partyzantów, to nieoczekiwanie dla najeźdźców przerodziła się w kilkunastogodzinną, krwawą bitwę. Poległo tam aż 19 amerykańskich bandytów, a jeden z nich dostał się do niewoli.
Poza tym, to nie Zachód wygrał z ZSRR, a tylko ZSRR przegrał sam ze sobą, a Zachód oszukańczo ogłosił to jako swoj sukces, mimo iż to była jego klęska, gdyż ZSRR był obliczalny i odpowiedzialny, a niektóre post-radzieckie republiki typu Gruzji, Mołdawii, Azerbejdżanu czy Ukrainy, sa nieobliczalne i nieodpowiedzialne, a więc i z ich winy może wybuchnąć III Wojna Światowa.
wiesiek59 4 CZERWCA 2022 15:38
OK, ale gdzie ja jestem agresywny? Ja się tylko bronię, a że najlepszą obroną jest atak…
Iga to znaczy Ogień!
Zwycięstwo w Paryżu w dobrym stylu!
Brawo!
Minister Spraw Zagranicznych (MEA) Jaishankar potwierdził swoje referencje jako jeden z czołowych wielobiegunowych konserwatywno-suwerennych (MCS) na świecie po tym, jak podczas piątkowego wydarzenia przypomniał Zachodowi, że świat nie kręci się wokół niego. Przemawiał w słowackim think tanku GLOBSEC i odpowiadał na pytania dotyczące polityki zagranicznej jego cywilizacyjnego państwa w okresie Nowej Zimnej Wojny , kiedy powiedział, że „Europa musi wyrwać się z myślenia, że problem Europy jest problemem świata, ale problemem świata”. nie jest problemem Europy”.
https://oneworld.press/?module=articles&action=view&id=2937
=========
W punkt.
Europa czy Zachód, nie jest pępkiem swiata….
ls42 4 CZERWCA 2022 16:24
Na jakim koksie ona jedzie?
kalvarya01
4 CZERWCA 2022
15:51
Wu Wei…..
Staram się do tej zasady stosować.
Choć w kilku przypadkach w ciągu ostatnich kilkunastu lat, się nie udało.
Trudno czasami ze względu na prymitywizm, chamstwo i głupotę adwersarzy
„Nie wyjść z siebie, i stanąwszy obok nie trzasnąć drzwiami”….
PAK4 4 CZERWCA 2022 14:28
1. Dla mnie, to każda okupacja to jest zło – czy niemiecka, czy jankeska czy też bolszewicka. Poza tym, to w „realu” mamy logikę co najmniej trzywartościową: tak, nie, nie wiem.
2. Wiesiek59 wyjaśnił już Ci, że Wojna Koreańska ma całkowicie inną genezę. Miały być ogłoszone wybory powszechne, które wygrałby Kim, powszechnie uważany wówczas w Korei za bohatera. Ale, komunista w Korei?
3. A czym on się zapisał ten Potocki w dziejach poza byciem agentem Wiednia?
4. NIE jestem „Wieśkiem”.
5. Indie produkują (niestety) mnóstwo oprogramowania, o czym wiem z autopsji, gdyż w kiedyś w Sydney (NSW), moja praca polegała na poprawianiu błędów programach dostarczanych z Indii i Izraela (proszę nie brać tego za anysemitzm czy też za uprzedzenia wobec Hindusów). Przewaga technologiczna USA ogranicza się zaś dziś już tylko do militariów i też nie wszystkich.
5.VW Golf z silnikiem Diesla to tylko taki przyklad. Jak wolisz, to może być to każdy tzw. SUV, jakże dziś modny wśród naszych polskich (i nie tylko polskich) nowobogackich. I czy słyszałeś o bombie neutronowej? Jest to odmiana bomby termojądrowej (wodorowej) o stosunkowo niewielkiej sile wybuchu, lecz wyzwalającej dużą ilość zabójczego dla organizmów promieniowania neutronowego.
6. Tak samo „pomoże” nam NATO – przypominam, że Artykuł 5 Traktatu Północnoatlantyckiego głosi, że „Strony zgadzają się, że zbrojna napaść na jedną lub kilka z nich w Europie lub Ameryce Północnej będzie uważana za napaść przeciwko nim wszystkim; wskutek tego zgadzają się one na to, że jeżeli taka zbrojna napaść nastąpi, każda z nich, w wykonaniu prawa do indywidualnej lub zbiorowej samoobrony, uznanego przez Artykuł 51 Karty Narodów Zjednoczonych, udzieli pomocy Stronie lub Stronom tak napadniętym, podejmując natychmiast indywidualnie i w porozumieniu z innymi Stronami taką akcję, jaką uzna za konieczną”. Czyli że USA mogą uznać, że zakaz publicznego wykonywania „Kalinki” na obszarze Hawajów stanowi taką akcję, jaką USA uzna za konieczną w przypadku ataku Rosji na Polskę.
7. Przecież USA to jest dziś państwowy terrorysta nr 1, nawet przed Izraelem.
8, Czyli ze uważasz że to jest nic złego w tym, że prezydent USA złoży niebawem wizytę w Arabii Saudyjskiej? Ale przecież, według Ciebie, to cel uświęca środki.
9. Skąd u ciebie ta pewność, że PNVD powstała nie na serio?
10. Dla mnie homoseksualizm powinien byc zakazany, gdyż prowadzi on do tego, że tzw. geje otwarcie składają mi czasami propozycje odbycia seksu ze mną W normalnym kraju, to za coś takiego poszliby za kratki, ale dziś na tzw. Zachodzie, to ja bym został skazany za „brak tolerancji” i „dyskryminację gejów”.
11. Uważam się za marksistę, a swoją drogą, to dominacja syjonistów w USA jest jedną z przyczyn upadku tego państwa. Chyba, że uważasz Henry Forda za głupka.
wiesiek59 4 CZERWCA 2022 16:39
TAK – Europa czy Zachód, nie jest pępkiem swiata… Ale wytłumacz to np. PAK4.
PAK4 4 CZERWCA 2022 14:28
Wedlug mnie, to homoseksualizm powinien być zakazany, gdyż prowadzi on m. in. do tego, że tzw. geje otwarcie składają mi czasami propozycje odbycia seksu ze mną W normalnym kraju, to za coś takiego poszliby oni za kratki, ale dziś na tzw. Zachodzie, to ja bym został skazany za „brak tolerancji” i „dyskryminację gejów”. 🙁
ls42 4 CZERWCA 2022 16:24
A co ja mam z tego?Ona przecież gra dla siebie, NIE dla Polski!
P.S.
Madryt zamyka największą gejowską saunę w stolicy, zidentyfikowaną jako główne ognisko małpiej ospy. Gazety donosiły, że Hiszpania przoduje na tle Europy w liczbie zarejestrowanych zakażonych a WSZYSTKIE PRZYPADKI zarejestrowane w jej regionie to mężczyźni, którzy mieli stosunki seksualne z innymi mężczyznami. (Dziennik ABC z 20 maja 2022).
W Hiszpanii ciekawostką jest, że mieszkańcy boją się opuszczać swoich domostw. Ryzyko jest ogromne, bo jeśli ktoś się tam włamie i udowodni, że przebywa powyżej 24 godzin, to nie można go wyrzucić z mieszkania!
Trzeba nadal uiszczać opłaty mimo, że mieszka nielegalnie ktoś obcy. Aby pozbyć się niechcianego lokatora, należy założyć sprawę sądową co trwa rok i więcej bez 100% gwarancji pozytywnego wyroku. W Hiszpanii grasują całe gangi, które specjalizują się w takich akcjach. A my tu o Polsce i rzekomego braku demokracji:)))
Zadziwiające jest podobieństwo decyzji.
Niemcy wykluczyli ze społecznosci Żydów i Słowian,
Angosasi, Rosjan.
Niemiecki rasizm jest potepiany.
Anglosaski wspierany przez wasali.
Ciekawe, do którego pokolenia ten ostracyzm sięgnie?
Rzadowe elity kilku krajów powinny być zaniepokojone.
Takiej Kanady czy USa, na przykład.
Dziadkowie mieli wszak rosyjskie obywatelstwo….
„Parafrazując, „o tym kto jest Rosjaninem decyduję JA” powróci?
Cóz za wspaniały wzorzec….
wiesiek59 4 CZERWCA 2022 17:42
Adolf H. Wiecznie Żywy. Przynajmniej na tzw. Zachodzie.
Klejnoty w brytyjskie koronie skąpane są we krwi ofiar w koloniach imperium … Tak sobie myślę prywatnie … krew widzą jedynie w rosyjskiej ropie i gazie … taki rusofobiczny daltonizm …
@wiesiek59
4 czerwca 2022
17:42
„Rzadowe elity kilku krajów powinny być zaniepokojone.
Takiej Kanady czy USa, na przykład.
Dziadkowie mieli wszak rosyjskie obywatelstwo….”
A co dopiero mówić o elitach takiego jednego kraju na I!
Tutaj będą mieli antyrusyci zagwozdkę!
W Israelu mówienie przez sen po rosyjsku to norma … Tak sobie myślę prywatnie … co wyssane … zamienia się w słowo …
@ kalvarya01
4 CZERWCA 2022
15:49
„Poza tym, to nie Zachód wygrał z ZSRR, a tylko ZSRR przegrał sam ze sobą…”
A przed chwila isales, ze Gorbaczow byl agentem Zachodu. Cos sie pogubiles w swoich zeznaniach 😉
„ZSRR był obliczalny i odpowiedzialny…”
A nieobliczalny Putin ma byc dobrym dla Rosjan i Slowian? Tak sobie mysle prywatnie… ze chyba nie 😉
@ls42
4 czerwca 2022
16:24
„Iga to znaczy Ogień!”
Wg googla Iga to znaczy po estońsku Wiek.
„Zwycięstwo w Paryżu w dobrym stylu!”
Ja bym uważał — w dobrym stylu byłaby wygrana tej czarnej. Przynajmniej w 50 procentach.
eche
4 CZERWCA 2022
18:07
Potomkowie Goldy czy Begina, to raczej polskie obywatelstwo….
Ale, co ptakiem wyleci to wołem wróci….
Prawo niezamierzonych konsekwencji obowiazuje.
A polaryzacja świata postępuje z szybkoscia światła.
kalvarya01
4 CZERWCA 2022
17:51
ODESSA wchłonęła wiele cennych nabytków.
Taki batalion 731 czy Mengele, Braun, na przykład.
Cel uświęca środki.
Oprócz „Ludowej historii Stanów Zjednoczonych” warto by napisać Ludową historię świata…..
Któż by się tego podjął- odkłamania przekaza obowiązującego w różnych krajach?
Choć w zasadzie Orwell w 1984 napisał już wszystko na ten temat.
Jak mozna manipulować trescią historii, odpowiednio manipulując faktami i ich interpretacją.
Ciemny lud to kupi.
eche 4 CZERWCA 2022 18:22
IGA to w Australii sieć takich sobie sklepów: https://www.iga.com.au
mfizyk 4 CZERWCA 2022 18:16
Tak, to nie Zachód wygrał z ZSRR, a tylko ZSRR przegrał sam ze sobą, przy pomocy zdrajców typu Gorbaczowa, by the way.
Putin jest zaś obliczalny – zobacz jak się on powstrzymuje przy tej operacji na Ukrainie, czyli na Małorusi, przed bombardowaniem centrów Kijowa, Charkowa czy Odessy. Przypominam, że Hitler zaczął wojnę z Polską od bombardowania nie tylko Westerplatte, ale też i Zamku Królewskiego w Warszawie, a Niemcy wciąż nam nie zwrócili kosztów jego odbudowy. Takich to mamy „sojuszników” w NATO i „przyjaciół” w UE.
eche 4 CZERWCA 2022 18:22
Iga jest to imię żeńskie, będące zdrobnieniem od imienia Jadwiga, czyli Hedwig. Jest to imię pochodzenia starogermańskiego i wywodzi się od słów hadu (walka) i wig (bój). A więc żadna ze Świątkówny Polka, a tylko Niemka, jak np. „Lewy”. :-(
wiesiek59 4 CZERWCA 2022 18:29
ODESSA ( Organisation der ehemaligen SS-Angehörigen) czyli Organizacja Byłych Członków SS, jest to założona pod koniec II wojny światowej z inicjatywy Heinricha Himmlera oraz byłych oficerów SS tajna siatka konspiracyjna, mająca na celu pomoc zbrodniarzom wojennym w ucieczce przed ścigającymi ich aliantami oraz zapewnienie im bezpiecznego życia po wojnie. Wielu z nich schroniło się po roku 1990 w Odessie.
Mit 4 czerwca 1989 roku :
To było oszustwo od początku do końca i skończyło się bezrobociem, bezdomnością, zapaścią demograficzną, piekłem kobiet, wygnaniem milionów Polaków z Polski i staniem się Polski wasalem USA, Watykanu i Niemiec. NIE ma więc czego świętować.
https://www.tokfm.pl/Tokfm/7,103087,28540928,sami-zapracowalismy-na-to-ze-nie-mamy-mitu-4-czerwca-rozwalilismy.html#s=BoxOpImg8
Cieszy mnie, że zauważyliście sukces tenisistki Igi Świątek. To też sukces kibiców i ich radość, gdy w Paryżu mogli oglądać nie tylko mecz, ale też uroczystość dekoracji obu sympatycznych pań rywalizujących w finale mistrzostw, ich pomeczowych wypowiedzi pełnych wzajemnego szacunku.
Pięknie zabrzmiał polski hymn na koniec uroczystości, a łzy wzruszenia Igi też były przyjemnym akcentem.
Aby być mistrzem trzeba całe lata pracować, trenować i poddać się surowej dyscyplinie zachowań. Dotychczasowe sukcesy zapisujemy na konto Igi Świątek, przeżywając równocześnie radość zwycięstwa. Jej rywalka ma zaledwie 18 lat. Czeka ją w przyszłości wiele wygranych bo ma talent i ciężko pracuje.
Już się cieszę na kolejny finał tych zawodniczek
@Izydor Danken
2 czerwca 2022
16:23
„Przecież Zelensky do gwiazda produktu Netflixu, a sponsorujący jego kampanię to magnat medialny Kołomojski, przedstawiciel jednej z mniejszości ukraińskich.
I chyba nic dziwnego, bo kto jak nie ludzie filmu, czy mediów wiedzą najlepiej jak tworzyć medialno-fabularny przekaz.”
Tak mnie jakoś teatrum ostatnich lat skłoniło do powrotu do starych lektur. A w nich, między innemi:
„—Wczoraj, gdy byłem w komitecie słyszałem przygotowane nagranie–rzekł Fall–przemówienie Cemolego do Narodów Zjednoczonych. Niesamowite, mówię panu.
— Kogo wzięli do tej roli?–zainteresował się John.
I dlaczego ja o tym nic nie wiem, pomyślał.
–Jednego miejscowego kabareciarza. Oczywiście nikogo znanego. Specjalizuje się w parodiach. Zdolny gość, nadał tej gadce świetne bombastyczne i złowróżbne brzmienie. Przyznam się, że bardzo mi sie to podobało.”
Autor wstępu do tej książeczki pisze zaś:
„Ale muszę wam powiedzieć prosto z mostu: nie chcę żyć w w świecie, jaki z taką zręcznością opisuje D. Chciałbym—rozpaczliwie chciałbym—ośmielić się wierzyć, że to nie jest ten nasz świat.”
Paryż … Napoleon … Polacy bronili Paryż przed Rosjanami … Tak sobie myślę prywatnie … o polskich drogach … i co z tego mamy …
Ukraińskie Ministerstwo ds Reintegracji Terenów Okupowanych podało, że nastąpiła wymiana ciał poległych żołnierzy w systemie 160 na 160.
To zabrzmiało groźnie
@kalvarya01 & Dekalog:
Jutro Beskidy czekają, więc odpowiem dzisiaj na to co jutro napiszesz, bo jutro nie będzie kiedy 🙂
Otóż, to co pisałem, to nie „interpretacja Dekalogu”, w sensie co powinniśmy rozumieć, albo co powiedział Bóg na Synaju, albo co ja bym chciał by Dekalog znaczył; tylko zreferowanie jak badacze zgadują (czasem z niepewnością — patrz kidnaping/kradzież/przywłaszczenie), że rozumiano Dekalog te 2,5+ tys. lat temu, gdy go spisywano. Wiadomo, że rozumienie się z czasem zmieniało i to nie odpowiada już, na przykład, dzisiejszemu (a nawet z I w. n.e.) rozumieniu judaistycznemu, czy — tym bardziej — chrześcijańskiemu. Chciałem tylko powiedzieć Stanisławowi by nie oczekiwał od Dekalogu za wiele.
@Wiesiek59:
Chodzi Ci o to, że seks z kobietą mógł być, hm… ekwiwalentem ślubu?
To ja trochę uprościłem.
Generalnie, gdybyś był starożytnym Żydem i przespał się z panną, to Twój status małżeński byłby nieistotny. Powinieneś:
– wpłacić „wykupne” jej ojcu;
– oraz być gotowym się z nią ożenić.
Być gotowym oznacza, że to ojciec dziewczyny decyduje. Gdyby jej ojciec uważał Cię za nicponia, to mógłby powiedzieć, że bierze pieniądze i zostawia córkę u siebie.
Generalnie sens był taki, że nie-dziewica* była mniej warta na rynku matrymonialnym i groziłoby jej pozostanie starą panną, a więc perspektywa biedy bez męskiej opieki i dochodów. Bo mąż, według praw Tory, miał wobec żony obowiązki — ma ją nakarmić, ubrać i coś jeszcze, co zwykle się rozumie jako „powinności małżeńskie” (ale znaczenie jest niepewne, biorąc analogie z innymi ludami, mogłoby chodzić o udostępnienie kosmetyków).
W tych wszystkich rozważaniach nie chodzi o „porwanie”, ale o jakiekolwiek… uwiedzenie. Trochę jest tu poczucia, że kobieta jest seksualnie bierna, że odpowiedzialność spada na mężczyznę** — i nie jest ważne, czy dwoje zakochanych się umówiło, czy też chłopak ją zgwałcił, czy cokolwiek po środku.
—
*) Czytam sobie „Permission Granted” Jennifer Bird akurat i wczoraj miałem rozdział o rozumieniu „cudzołóstwa” w Biblii. Pani Bird skraca myśl tego przykazania z Biblii do twierdzenia, że zakazane jest czerpanie przyjemności z kogoś, kto należy do innego mężczyzny. Ale jak ja czytam Biblię, to wychodzi mi, że tam bardzo często w przepisach chodzi o zwykłe ustalenie ojcostwa. Nie-dziewica może być w ciąży, a taką biorąc za żonę ryzykuje się przekazanie majątku w spadku nie swojemu dziecku. Oczywiście, my wiemy ile trwa ciąża (a starożytni generalnie wiedzieli, że w czasie ciąży ustaje miesiączka i też plus-minus znali jej czas trwania), ale oni nie znali tego mechanizmu tak dobrze, by być absolutnie pewni.
**) W innym prawie jest, że jeśli do gwałtu na dziewczynie już komuś przyrzeczonej doszłoby w mieście, to oboje są winni i powinni zostać ukamienowani. Ale jeśli poza miastem, to winny jest tylko gwałciciel. Sens: w mieście wystarczy zawołać o pomoc by się ustrzec.
SŁOWIANIN STANISŁAW
„Gdyby religie były pokojowe nie byłoby wojen”.
Politycy przekazują przywódcom religijnym ogromne pieniądze głównie po to, żeby religie nie były pokojowe.
Szczególnie znane z obłudy w tej dziedzinie są kraje chrześcijańskie. Podczas dwóch wojen światowych na rozkaz „chrześcijańskich” przywódców politycznych katolik zabijał katolika, a protestant protestanta. Walczącym po jednej i po drugiej stronie duchowni wpajali, zgodnie z oficjalnym nauczaniem swojej religii, że ich wojna jest sprawiedliwa, a więc cieszy się uznaniem i błogosławieństwem Bożym.
Przywódcy religijni już od wielu stuleci umacniają w takiej wierze poddanych i grają na ich uczuciach.
Debata tygodnia
Omawiany artykuł drugi konstytucji UE
Jak rozumieć zasadę równości?
Czy inni mają się dostosować do mnie, czy ja do kogoś innego?
A gdzie dawne zasady „Wolność, równość, braterstwo”?
Jak należy oceniać odgradzanie się Polski od Białorusi murem granicznym, a od Obwodu Kaliningradzkiego nie?
Na pewnym odcinku granicy z Niemcami dzieli nas rzeka Odra. Zupełnie nie mamy pretensji o granice z Czechami i Słowacją. Pozostaje granica z Ukrainą
@ kalvaryja
@ wiesiek
Ujawnil sie nowy agent Zachodu na Rosji, niejaki Girkin vel „Striełkow”. Poczytajcie co on mowi o waszym Putinie:
„Bo Putin, proszę was, zapomniał o rosyjskiej racji stanu. A swoich kierowców i kucharzy uczynił miliarderami. Jak bracia Rotenbergowie, którzy są po prostu okupantami Rosji. Albo taki Szojgu – on powinien zostać skazany za kryminalne zaniedbania! (…) Nasza władza jest do cna skorumpowana. A armią rządzą, drodzy słuchacze, no rządzą nią po prostu idioci.”
Ach, ta biedna Rosja. Znowu ja Zachod napada 😉
Polka w Paryżu
Nie wpadam w hurra optymizm, ale dzielę się z radością z miłego wydarzenia, jaką jest wygrana Igi Świątek w turnieju Wielkiego Szlema, nie umniejszając sukcesu jej rywalce Amerykance, która dotarła do finału bez straty seta pokonując po drodze sześć rywalek, zanim sama została pokonana przez Polkę.
Media to szeroko komentują i jeszcze będą miały o czym pisać. Do 27 czerwca, czyli dnia rozpoczęcia kolejnej imprezy Wielkiego Szlema w Londynie, jest czas rozmów, analiz i odpoczynku, chociaż trwają i będą trwać inne zawody sportowe.
Skoro jednak nasza mistrzyni pamięta o Ukrainie, nosi na czapce przypinkę w ukraińskich barwach i życzy Ukrainie wygranej, to nie sposób zauważyć, że to proste nie będzie skoro strony tego konfliktu mają zupełnie inne cele i żadne z walczących państw nie chce ustąpić nawet na jotę.
Olborski skrytykował mnie za wpis na tutejszym blogu dotyczący dziejących się tam i nie tylko tam wydarzeń. Jeżeli się nie mylę szanowny komentator podchodzi do sprawy z daleka, z kraju pachnącego żywicą, mającego mało zmartwień, a dużo pieniędzy. To jest całkowicie inny punkt widzenia, niż mój. Do tego krytyka, że mieszkam we Wrocławiu nie wydaje się stosowna.
Nikt obecnych granic Polski nie kwestionuje i niech tak zostanie. Zatem dążmy do zachowania równowagi i wspierajmy tych co mają możliwości doprowadzenia do spokoju na Ukrainie, chociaż to wymaga wysiłku.
Życząc dobrej nocy wszystkim ludziom dobrej woli chciałbym zakończenia wojny na Ukrainie i powrotu obywateli tego kraju do własnych domów.
ls42 4 CZERWCA 2022 19:31 – c.d. off topic:
Ta moja dywagacja na temat imienia Iga czyli Hedwig (4 CZERWCA 2022
19:09), to była tylko w związku ze „Świątkomanią” sztucznie podsycaną w polskojęzycznych mass mediachg. Zresztą taka np. Wanda jest czysto germańskim imieniem a podobno nie chiała ona Niemca. Znany polski pilot. m. in. Dywizjonu 303 i pisarz Bohdan (imię ukraińskie) Arct (nazwisko germańskie), w niewoli został przywitany przez komendanta Ofglagu z czysto polskim nazwiskiem.
Keller pochdzi zaś z łaciny, od Cellaruis, czyli legionista zajmujący się piwnicą win, która była w każdym szanującym się rzymskim obozie na „apoleońskiejl” zasadzie, że wojsko maszeruje na żołądkach i stąd np., w Szkocji klan Mckellar spokrewniony z klanem McCampbell (dzwon obozowy) i stąd też moja ulubiona whisky to Clan Campbell – nazwa na cześć jednego z największych i najpotężniejszych klanów Highland (górskich). Ziemie tego klanu zaczynały się w Argyll na zachodzie, na wschód do Perth i Kinross i rozciągały się na północ aż do Nairn. Początki klanu Campbell należą do starożytnych Brytyjczyków ze Strathclyde.
Co ciekawsze, to historia whisky Clan Campbell rozpoczyna się roku 1933 i związana jest z żydowskim kupcem, niejakim Samuelem Rosenbloomem (Rosenblumem). Początkowo zajmował się on handlem winem, jednak w 1933 w Glasgow rozpoczął handel whisky rejestrując firmę pod niezbyt koszerną nazwą Forbes McGregor & Co. Krótko po tym zaczął nazywać siebie Ross Campbell. W 1948 roku zakupił on spółkę Muir Mackenzie & Co., w ramach której opracował po raz pierwszy skład whisky Clan Campbell. W kolejnych latach spółka ta została wykupiona przez Pernod Ricard, a do zarządu holdingu (House of Campbell) powołano Szefa Klanu Campbell – księcia (Duke) Argyll.
https://www.ccsna.org
https://kukunawa.pl/i_CLAN-CAMPBELL-40–0-75L,9198
To tyle na dzis rano,
Pozdrawiam
Dezerter83 4 CZERWCA 2022 20:38
To dlaczego Jehowici (ŚJ) przyjmowali i dalej przyjmują finasowanie z CIA – dawniej w celu szerzenia defetyzmu i pacyfizmu w tzw. demoludach, w tym szczególnie w Polsce i dlaczego teraz są oni używani przez w/w CIA w walce z Watykanem a raczej z obecnym katolickim biskupem Rzymu, który nie za bardzo dał się wciągnąć w szerzenie antyrosyjskiej demagogii, jakże dziś powszechnej na tzw. Zachodzie?
PAK4 4 CZERWCA 2022 20:00
A tu zgoda.
eche 4 CZERWCA 2022 19:42
DOBRE!
SŁOWIANIN STANISŁAW 4 CZERWCA 2022 19:52
Broniliśmy Wiednia przed Turkami i w nagrodę dostaliśmy rozbiory. Walczyliśmy z III Rzeszą, aby Ukraińcy zabrali nam Lwów, Litwini – Wilno a Białorusini – Grodno.
ls42 4 CZERWCA 2022 20:44
W realnym kapitalizmie, tak jak w niewolnictwie czy feudalizmie, równość może istnieć tylko w teorii, gdyż w praktyce, to prawdziwa demokracja wymaga także równości materialnej (posiadania i dochodów), a nie tylko formalnoprawnej. W warunkach nierówności posiadania i dochodów, demokracja szybko degeneruje się bowiem w plutokrację albo dyktaturę jakiegoś satrapy.
Ukraina … ogrom zniszczeń i ofiar w razie konfliktu był do przewidzenia … ale Zełeński nie ma przewidywalności na poziomie prezydenta Hacha … choć teraz coś sugeruje o ochronie żywych … Tak sobie myślę prywatnie … z rusofobią zaczyna przypominać organizatorów Powstania Warszawskiego z 200 000 ofiar ludności cywilnej … o ruinach nie wspomnę … bij Moskala … ! a zbawiona będzie dusza twoja … ! sława … !
Dezerter83 4 CZERWCA 2022 20:38
Jak konkretnie Jehowici walczą w USA z tamtejszym kompleksem militarno-przemysłowym?
SŁOWIANIN STANISŁAW 5 CZERWCA 2022 7:07
Racja!
Drogi Dezerterze:
Czy CIA przeniknęło do wyższych sfer organizacji Strażnica?
Wezwanie Strażnicy skierowane do wszystkich kongregacji, by zatrudniały księgowych i prawników, a zwłaszcza tych, którzy znają się na prawie podatkowym, każe mi się poważnie zastanowić, że mogą być oni w gorącej wodzie kąpani. Ponieważ organizacja Strażnica w przeszłości bardzo głośno mówiła o swoim antyrządowym nastawieniu i o usuwaniu ze swych szeregów osób, które wstępują do wojska lub na inne stanowiska rządowe, jestem skłonny spekulować, że Agencja Wywiadowcza Stanów Zjednoczonych czyli CIA widziała potrzebę przemycenia kilku swoich agentów do sekty Jehowitów, w celu zapewnienia bezpieczeństwa wewnętrznego USA. Jestem też pewien, że Urząd Skarbowy USA bacznie obserwuje działalność Jehowitów, ponieważ jest to ogromna kasa i nieuczciwa sekta kontrolująca umysły.
Czy FBI nie infiltrowało sekty Davidian?
I jeszcze jedno pytanie, na które może odpowiedzieć ktoś, kto zna się na prawie podatkowym: Czy organizacje charytatywne nie podlegające opodatkowaniu nie muszą rozliczać się z otrzymanych i wydanych pieniędzy z Urzędem Skarbowym? Wydaje mi się, że tak, a ponieważ jest tak wiele pieniędzy, które mogą być oszukańczo wyprowadzane z podatków przez nieuczciwe antyrządowe kulty kontrolujące umysły, jestem pewien, że Urząd Skarbowy USA ma wiedzę, aby „przyskrzynić” tych frajerów. Jest to po prostu rozsądne z biznesowego punktu widzenia, aby skarbówka od razu wykrywała tego typu oszustwa. Myślę nawet, że skarbówka ma ogromne komputery z oprogramowaniem, które może skanować Internet, zapisy bankowe itp., które wysyłają czerwone flagi i wyłapują tych oszustów unikających płacenia podatków.
Jakieś przemyślenia na ten temat?
https://www.jehovahs-witness.com/topic/87475/has-cia-infiltrated-upper-echelon-watchtower-organization
Przetłumaczono przy użyciu http://www.DeepL.com/Translator (wersja darmowa z moimi poprawkami)
Drogi Dezerterze – patrz też np.:
http://jwdivorces.bravehost.com/spies2.html
To jest na temat WATCHTOWER SOCIETY – JEHOVAH’S WITNESSES -„SPIES” & „SECRET AGENTS” czyli STOWARZYSZENIE STRAŻNICA – ŚWIADKOWIE JEHOWY – „SZPIEDZY” I „TAJNI AGENCI” .
PRL wyciągnął Polaków z nędzy, a solidaruchy z PO-PiS-u ich w nią znów wpychają:
https://www.tokfm.pl/Tokfm/7,103085,28541780,koledzy-robia-listy-kolejkowe-20-40-telefonow-dziennie-im.html#s=BoxOpImg10
Drogi Dezertzrze,
Jakie jest oficjalne stanowisko ŚJ w sprawie nadchodzącej wizyty prezydenta USA w Arabii Saudyjskiej i wojny prowadzonej przez tą Arabię w Jemenie?
Czy Świątek upomni się o los więżniów Guantanamo i mieszkańców gett zwanych rezerwatami dla rdzennej ludności … Tak sobie myślę prywatnie … Rosja upomniała się o los Rosjan na terytorium banderowskiej Ukrainy … którym odmówiono statusu rdzennej ludności … w przeciwieństwie do banderowców …
SŁOWIANIN STANISŁAW 5 CZERWCA 2022 7:54
Raczej nie. Ona jest przecież finansowana z USA. Tak jak dawniej K. Wojtyła i TW Bolek.
Nagonka na Rosję przypomina w stylu polowanie jankesów na zbiegłego na mokradła niewolnika … z psami gończymi … w tej roli kolaboranci … Tak sobie myślę prywatnie … kibicuję zbiegowi … watahy budzą obrzydzenie … jak sugeruje papież …
Zełeński odwołał banderowską rzeczniczkę praw człowieka bo drażniły jej raporty … zamiast wrócić do Mińska … Tak sobie myślę prywatnie … masz gorączkę stłucz termometr … mawiał Wałęsa … fan papieży …
Rosjanie zniszczyli jakiś drewniany kościół w Kijowie. Żeleński zażądał wykluczenia Rosji z UNESCO. Ani on, ani jego 9-letni „doradca wojskowy” nie pojęli, że Rosjanie dali jednoznaczny sygnał – ” jesteście w zasięgu naszej broni!”
Bóg kule nosi … Tak sobie myślę prywatnie … dlatego papież z pokorą przyjmuje bratobójczy spór potomków Rusa …
https://www.nakedcapitalism.com/2022/06/the-war-situation-has-developed-not-necessarily-to-ukraine-or-the-wests-advantage-but-they-plan-to-negotiate-when-theyve-turned-things-around-a-bit.html
==========
Dobry komentarz:
Lex
3 czerwca 2022 o godzinie 7:45
W zarządzaniu imperium amerykańskim nigdy nie brano pod uwagę życia ludzkiego, ale to jest skrajne nawet dla nas. Rzeź, której żądamy w żadnym innym celu niż niezdolność Joe Bidena do przyznania się, że się mylił, jest oszałamiającym oskarżeniem wobec nas. Dobrze wiemy, że Ukraina wysyła na front prawie emerytów i dzieci bez szkolenia i AK do udziału w wojnie artyleryjskiej. Wiemy, że jedyną nadzieją dla ukraińskich wojsk jest brak amunicji w Rosji. A być może najgorsze jest to, że wiemy, że nadchodzi czas, w którym nastąpi znaczący upadek ukraińskiej obrony. Kiedy tak się stanie, dosłownie nic nie powstrzyma rosyjskich sił przed przejęciem takiej części Ukrainy, jak chcą.
Byłbym skłonny argumentować, że nasze zachowanie w Iraku, Afganistanie (głodzący Afgańczycy), Jemenie itp. jest gorsze pod względem całkowitej śmierci. Ale to jest poziom bezduszności, który jest inny, ponieważ podobno Ukraina jest naszym przyjacielem, ponieważ „wspieramy” Ukrainę. Prawdziwymi zbrodniarzami wojennymi jesteśmy my. Podobno my „putinowskie marionetki” jesteśmy jedynymi, którym rzeczywiście zależy na losie Ukraińców. Całe swoje dorosłe życie spędziłem zniesmaczony zachowaniem mojego narodu, ale to jest gorsze niż to sobie wyobrażałem. Odrzuciłem pozycję FSO w 02, ponieważ nie mogłem zostać trybikiem w imperialnej maszynerii; patrząc wstecz, moja analiza sumienia była banalna. Jest o wiele gorzej, niż sądziłem. Flagi miasta wciąż wisiały z okazji Dnia Pamięci i nie czułem nic poza wstydem, przejeżdżając obok nich wczoraj.
https://www.thepostil.com/jacques-baud-the-goal-is-not-to-help-ukraine-but-to-fight-putin/
TK: To znaczy, że Zachód promuje kryzysy?
JB:TAk. W 2014 roku zaobserwowano podobny mechanizm. Zachodni „eksperci” i media bagatelizowały opór Ukraińców wobec zmiany reżimu. Trzeba było pokazać, że rewolucja na Majdanie była demokratyczna. Zbudowali więc mit armii ukraińskiej, która zwyciężyła z rebeliantami. Po klęsce rządu w Doniecku trzeba było wymyślić pretekst do rosyjskiej interwencji, by usprawiedliwić zachodnią propagandę. Tak powstały pierwsze porozumienia mińskie (wrzesień 2014). Zaraz potem Kijów złamał podpisaną umowę o rozpoczęciu operacji antyterrorystycznej (ATO). Doprowadziło to do drugiej porażki w Debalcewie i drugiej umowy z Mińska (luty 2015). Po raz kolejny klęskę Ukrainy przypisano interwencji rosyjskiej. Dlatego zachodni „eksperci” nadal twierdzą, że umowy te zostały podpisane między Ukrainą a Rosją, co nie jest prawdą. Porozumienie mińskie zostało podpisane między Kijowem a przedstawicielami samozwańczych republik Ługańska i Doniecka.
Rosjanie w Donbasie i okolicy jak Irlandczycy u angoli … Tak sobie myślę prywatnie … Donbas idzie na skróty … łączy rodziny … są u siebie …
TK: Co rozumiesz przez „Noworosję” i jak powinna wyglądać terytorialnie?
JB: Po zniesieniu w 2014 roku ustawy o języku urzędowym powstały nie tylko obwody ługański i doniecki, ale całe rosyjskojęzyczne południe Ukrainy. W rezultacie w październiku 2014 r. powstały Zjednoczone Siły Noworosji, w skład których wchodzą jednostki z samozwańczych republik: Odessy, Charkowa, Dniepropietrowska oraz oczywiście Ługańska i Doniecka. Ocalały tylko Ługańsk i Donieck. Inne „republiki” zostały brutalnie stłumione przez paramilitarne siły Kijowa. Dziś Rosjanie wykorzystują odrodzenie Noworosji jako zachętę dla Ukraińców do pójścia do stołu negocjacyjnego. Jeśli nie zechcą, Rosja zwiększy presję.
@ kaesjot
5 CZERWCA 2022
9:32
Putin uczyl sie (wspol)zycia u obszczymurkow i bandytow w Petersburgu. I od 20 lat to coraz bardziej wychodzi. Nawet Girkin to juz widzi.
PS. „jakis kosciol”? Sprawdz najpierw dokladnie, o ktory to chodzi.
Termin „państwo cywilizacyjne” jest najczęściej stosowany do Chin. Zarówno starożytne, jak i współczesne. Już w czasach starożytnych Chińczycy rozwinęli teorię „Tianxia” (天下), „Niebiańskie Imperium”, zgodnie z którą Chiny są centrum świata, miejscem spotkań zjednoczenia Nieba i podziału Ziemi. A „Imperium Niebieskie” może być jednym stanem; lub może być podzielony na części, a następnie ponownie złożony. Ponadto same Han Chiny działały jako siła kulturotwórcza dla sąsiednich narodów, które nie były bezpośrednio częścią Chin – głównie Korei, Wietnamu, krajów Indochin, a nawet Japonii, która jest dość niezależna.
Państwo narodowe jest produktem europejskiego New Age, aw niektórych przypadkach konstruktem postkolonialnym. Państwo cywilizacyjne ma pradawne korzenie i niepewne, przesuwające się granice. Stan cywilizacyjny momentami pulsuje, rozszerza się i kurczy, pozostając zawsze zjawiskiem stałym. (To przede wszystkim musimy wiedzieć o naszym SMO.)
https://www.thepostil.com/civilization-state-or-the-multi-polar-world/
Ciekawe zjawisko … banderowcy zarzucają Węgrom pacyfikację banderowców w czasie II WŚ … Tak sobie myślę prywatnie … arogancja banderowców sięga zenitu … pierwsi rzucają kamieniem …
Jako Kanadyjczyk mam spore doświadczenie z rodzimą wersją kanadyjskiego faszyzmu, który naturalnie przyciągał galicyjskich zbrodniarzy wojennych pod koniec II wojny światowej. Faszyzm kanadyjski różni się od amerykańskiego, jest bardzo subtelny. Ale zauważysz, że nawet oficjalna „postępowa” partia – NDP – nasza wersja brytyjskiej Partii Pracy – konsekwentnie głosuje za poparciem kanadyjskiego imperializmu za granicą – obalenia demokracji na Haiti – próby obalenia kilku innych latynoamerykańskich demokracje i poparcie dla amerykańskiego imperializmu – no cóż – wszędzie. Aby być Canuckiem, trzeba być faux liberałem. Ale Kanada upadnie jako naród – kiedy to zrobią Stany Zjednoczone. A upadek USA jest nieunikniony. Stany Zjednoczone i Kanada są jak Cesarstwo Japońskie, które rozpoczęło wojnę, której nie mogło wygrać i wiedziało, że jest pokonane do 1944 roku. Imperium nadal wykorzystywało propagandę w celu zdobycia narodowego konsensusu i samobójstwa jako taktyki. Ameryka jest na etapie ładowania Banzai. W przyszłym roku wszystko się zmieni i zobaczysz, że Unia się rozpada. To samo: „konfederacja” w Kanadzie. Dla japońskiej perspektywy przeczytaj tutaj https://julianmacfarlane.substack.com/p/usa-civil-war-2023?s=w
Wysłane przez: Julian Macfarlane | 5 czerwca 2022 3:12 utc | 152
Miedwiediew poruszył także perspektywę zerwania stosunków dyplomatycznych z krajami zachodnimi, mówiąc: „nie ma szczególnej potrzeby utrzymywania stosunków dyplomatycznych” i dodając: „Możemy patrzeć na siebie przez lornetkę i celowniki”.
Odnosząc się do zachodnich groźby zamrożenia aktywów rosyjskich firm i osób, Miedwiediew ostrzegł, że Moskwa nie zawaha się zrobić tego samego.
„Musielibyśmy zareagować w naturze, zamrażając aktywa obcokrajowców i zagranicznych firm w Rosji… i być może nacjonalizując aktywa tych, którzy pochodzą z nieprzyjaznych jurysdykcji” – powiedział. „Najciekawsze rzeczy dopiero się zaczynają”.
https://www.aljazeera.com/news/2022/2/26/senior-russian-security-official-issues-stark-threats-to-the-west
==========
Miedwiediew zdjął rękawiczki….
Nad Wisłą zbratano się z potomkami faszystów węgierskich i banderowcami ukraińskimi … Tak sobie myślę prywatnie … takie polityczne więzy w tradycji Piłsudskiego organizatora majowego majdanu …
@wiesiek59
4 czerwca 2022
18:26
„eche
4 CZERWCA 2022
18:07
Potomkowie Goldy czy Begina, to raczej polskie obywatelstwo….”
Kiedy pisałem o państwie na I, miałem na myśli raczej świeższej daty imigrację rosyjskojęzyczną, która stanowi tam obecnie coś około 15% populacji i sporą siłę polityczną. Stąd może niejaka powściągliwość tego państwa, gdy chodzi o przyłączanie się do antyrosyjskiej koalicji? Musieliby zostać państwem antysemickim (w 15%)! Nawiasem mówiąc, pewne państwo na P. jest już w ok. 7% ukraińskojęzyczne. Tak tylko sobie śmiem zauważyć.
Rząd Polski zamierza w przyszłym roku wyemitować obligacje na kwotę ok. 10 mld funtów (ok. 53,6 mld zł) na rzecz utrzymanie 3,5 mln ukraińskich uchodźców w Polsce. Nie robi emisji w PLN ze względu na wysokie odsetki jakie musiałby zapłacić za obligacje denominowane w złotych.
https://www.telegraph.co.uk/business/2022/05/29/poland-prepares-issue-emergency-debt-ukrainian-refugees-flood/
============
Hmm…..
To na pewno POLSKI rząd?
@kalvarya01
5 czerwca 2022
6:51
„eche 4 CZERWCA 2022 19:42
DOBRE!”
No pewnie — Ph. K. Dick pisał niezłe opowiadania, gotowe scenariusze.
Ja zaś mam od dłuższego czasu dziwne jakieś takie odczucie, że polityka US jest w dużej mierze tworzona przez speców z Hollywood. Tyle że raczej kiepskich. Ewentualnie tworzą ją politycy edukowani na produktach rodem z H., lub teraz dodatkowo z Netflixa.
Przypomina mi to anegdotkę. Jakiś dziennikarz rozpoczął wywiad z szefem MGM od wstępu:
„–Rozmawiam z szefem największej wytwórni w Hollywood.”
Ten zaś mu wtedy przerwał
„– Mylisz się — największa wytwórnia w Hollywood nie nazywa się MGM. Największa wytwórnia tutaj nazywa się
Pentagon.”
Tylko tak sobie myślę, że wtedy to pies machał ogonem, a teraz jest na odwrót.
Ciekawostki przyrodnicze dla PAKa4, małego fizyka i innych entuzjastek i entuzjastów zachodnich swobód:
1. Senat Uniwersytetu im. Adama Mickiewicza w Poznaniu przegłosował skrajnie „genderowy” projekt „polityki równościowej i antydyskryminacyjnej”. Rektor uczelni profesorka (zapewne też i doktorka habilitowana), niejaka Bogumiła Kaniewska zapowiedziała, że rozpocznie wdrażanie dokumentu, w którym stwierdzono, że zwracanie się do drugiej osoby zgodnie z jej płcią biologiczną jest formą molestowania.
2. Warszawskie liceum im. Jana III Sobieskiego przeznaczyło jedno z pomieszczeń na specjalną toaletę dla „osób niebinarnych, transpłciowych i nieokreślających się”. Efektem wprowadzenia takich genderowych toalet w amerykańskim stanie Wirginia było zaś to, że udający dziewczynę uczeń zgwałcił 15-letnią koleżankę.
wiesiek59 5 CZERWCA 2022 13:24
Tak samo polski, jak polskim był rząd GG.
Wiesiek59 5 CZERWCA 2022 12:00
Kanada to sztuczny twór brytyjskiego i francuskiego imperializmu, ale tylko na marginalnych Nowych Hybrydach oba te imperializmy potrafiły ze sobą współpracować.
kaesjot 5 CZERWCA 2022 9:32
Cerkiew. Swoją drogą, to za Sanacji niszczono „policyjnie” cerkwie na kresach wschodnich RP.
https://thesaker.is/japans-perceptions-of-the-propaganda-regarding-the-smo/
====
Widziane z Japonii….
„I usłyszałem głos pośród zwierząt mówiący: Miarka pszenicy za denara, a trzy miarki jęczmienia za denara; i nie krzywdź oliwy i wina”.
Apokalipsa 6:6
Wprowadzenie: 6 czerwca 1945
https://thesaker.is/operation-z-on-raising-the-iron-curtain-which-hangs-over-europe/
========
Na blog Exignoranta aż strach wchodzić.
Tyle tam apokaliptycznych doniesień na temat efektów niedoboru bądź nadmiaru wody w głównych centrach upraw na globie…..
Dla Dezertera:
Każda przemoc jest zła, powinna być potępiana i surowo karana, a przemoc względem dzieci szczególnie. Tym bardziej gdy przemoc ta ma podłoże seksualne. Takie nieludzkie żądze niszczą psychikę małego człowieka na zawsze, rzucają cień na jego dalsze życie i relacje międzyludzkie.
Tak bardzo szokują więc wszelkie próby ukrycia przestępstw na tle seksualnym względem dzieci. Każda zdrowa społeczność potępia wszelkie dewiacje i patologie oraz nie unika odpowiedzialności, kiedy takie przypadki mają miejsce. Reakcja taka jest zrozumiała i bezsporna. Dorośli, a zwłaszcza ci, którzy powołują się na najwyższe wartości, powinni się nimi kierować zawsze i wszędzie.
Wyjątek w tej kwestii stanowią świadkowie Jehowy. Po zgłoszeniu takiego przestępstwa starszym zboru (osoby duchowne w tym związku wyznaniowym – tylko i wyłącznie mężczyźni), poszkodowani nie mogą liczyć na wsparcie, ani czuć się bezpieczni. Ofiara – dość często kilkuletnie dziecko – jest zasypywana gradem pytań przez osoby nie posiadające wykształcenia psychologicznego. Nie może też liczyć na dyskrecję, gdyż społeczność ta składa się z niewielkich grup nazywanych zborami, w których wszyscy bardzo dobrze się znają. Są to pytania bardzo osobiste, intymne, upokarzające dorosłą osobę, a co dopiero małe dziecko.
Całej dramaturgii dodaje fakt, że owo przesłuchanie odbywa się w obecności oprawcy. Organizacja swoje praktyki opiera na biblijnej zasadzie dwóch świadków, którą zgrabnie dopasowała do swoich wymyślnych zasad. Oto fragment listu do starszych, jaki wystosowało Ciało Kierownicze, odnośnie do przeróżnych oskarżeń, w tym także tych seksualnych: Oceniając dowody na wewnętrzne potrzeby zborowe, muszą jednak pamiętać o wyraźnej zasadzie biblijnej: „Nie może jeden świadek wystąpić przeciwko człowiekowi w związku z jakimś przewinieniem lub jakimś grzechem […]. Sprawa ta ma zostać potwierdzona ustami dwóch świadków lub ustami trzech świadków” (Powt. Pr. 19:15). Wymóg uzyskania potwierdzenia dwóch lub trzech świadków powtórzył Jezus (Mat. 18:16). Dlatego chociaż starsi badają każde oskarżenie, Pismo Święte nie daje im prawa do podejmowania jakichkolwiek działań w zborze bez przyznania się do winy albo zeznań dwóch lub trzech wiarygodnych świadków.
Jak to się ma do rzeczywistości?
Bardzo tragicznie. Każdy dewiant dba o to, aby nie mieć naocznych świadków swoich obrzydliwych czynów. Jest więc słowo, przeciwko słowu. Taki osobnik zazwyczaj idzie w zaparte i jego haniebne czyny uchodzą mu płazem, a co gorsza może dalej bezkarnie krzywdzić dzieci, za cichym przyzwoleniem organizacji i współbraci. Notorycznie zamiata się tego typu sprawy pod dywan. Nawet jeśli taka osoba zostanie na pewien czas usunięta ze społeczności Świadków Jehowy, to powodów jej izolacji nie ujawnią się. Po pewnym czasie może wrócić do organizacji i krzywdzić kolejne dzieci, a pozostała część współwyznawców żyje w nieświadomości z kim obcuje.
Towarzystwo Strażnica uważa ten nikczemny czyn wyłącznie za grzech, a nie za przestępstwo jak to jest uznawane w każdym państwie prawa. Co za tym idzie, nie ma też nigdzie wzmianek, ani sugestii, aby powiadomić odpowiednie organy ścigania, by przerwać przeraźliwy proceder. Psychomanipulacje wewnątrz organizacji bardzo zniechęcają ofiary do wszczęcia odpowiednich kroków prawnych przeciw oprawcy ze zboru. U ofiary często stosuje się technikę psychomanipulacji polegającej na wzbudzeniu w niej poczucia winy. Takie praktyki często zniechęcają ofiary do zgłoszeniu się do instytucji świeckich, które by im pomogły.
CDN
C.D.
Ten problem istnieje na całym świecie. Organizacja świadków Jehowy płaci milionowe odszkodowania ofiarom pedofilii w Stanach Zjednoczonych, Wielkiej Brytanii, Kanadzie i innych państwach, gdzie nie istnieje przedawnienie sprawy. Jednak w Polsce prawo, które jakiś czas temu zostało znowelizowane pozwala ofierze zgłosić się do władz do 30 roku życia. Po tym okresie sprawca staje się bezkarnym, a sprawa przedawniona. Jeśli ktoś zdobędzie się na odwagę i powiadomi wymiar sprawiedliwości o przestępstwie, jest traktowany jak donosiciel, który oczernia swoich braci, oraz dobre imię organizacji. Dla Świadków to jak wystąpienie przeciwko wytycznym Boga. Jednak organizacji bardziej zależy na jej dobrym imieniu niż na sprawiedliwości i dobru innych, zwłaszcza dzieci.
Ogromnym przełomem w tej bulwersującej sprawie było ujawnienie afery pedofilskiej w Zborze w Australii (TVN24). Przez lata Świadkowie Jehowy na całym świecie, propagowali brak zaufania do władz świeckich, nie informując ich o przypadkach pedofilii oraz innych nadużyć, wręcz je ukrywając, a czasem nawet usprawiedliwiają. Oto cytat z czasopisma rozpowszechnianego przez świadków Jehowy: A co z osobą napastującą dzieci? Jak ma się rzecz z ochrzczonym dorosłym chrześcijaninem, który dopuścił się nadużyć seksualnych na dziecku? Czy jest do tego stopnia niegodziwy, że Jehowa nigdy mu nie przebaczy?
„Nigdzie natomiast w Biblii nie powiedziano, że nie może uzyskać przebaczenia dorosły chrześcijanin, który wykorzystywał seksualnie dzieci — swoje własne bądź cudze.
Przebudźcie się! Nr 1, 1997 r.
Wiosną 1997 roku Towarzystwo Biblijne i Traktatowe Strażnica, organizacja, który nadzoruje świadków Jehowy wysłała list do każdego ze zborów na całym świecie. Jej zaniepokojenie wzbudziły konsekwencje prawne związane z molestowaniem dzieci w szeregach świadków Jehowy. Według wytycznych w/w listu każdy zbór miał sporządzić szczegółowy raport dotyczący wszystkich przypadków molestowania nieletnich. Starsi zobowiązani byli do wysłania protokołu w niebieskiej kopercie do siedziby Strażnicy. W ten sposób świadkowie Jehowy stworzyli największą na świecie bazę danych dotyczących molestowanych dzieci, która jest wciąż aktualizowana.
Na podstawie tej bazy danych Australijskie dochodzenie w 2015 roku wykazało, że odsetek sprawców wynosi 1,5 % w stosunku do 68 000 populacji świadków Jehowy w tym kraju, a więc ponad 1000 potencjalnych zboczeńców. Na całym świecie jest w tej chwili ponad 8 500 000 wyznawców Jehowy…
Oto wypowiedź jednego z członków Australijskiej Komisji Królewskiej: Przed Komisją Królewską zostaną przedstawione dowody, że od 1950 roku żaden z 1006 domniemanych przypadków wykorzystywania seksualnego dzieci przez Świadków Jehowy nie został zgłoszony władzom świeckim.
Afera pedofilska w Australii była na tyle poważna, że przed komisją zeznawał jeden z członków Ciała Kierowniczego (grupa mężczyzn nadzorująca ogólnoświatową działalność świadków Jehowy) Jeffrey Jackson. Przesłuchanie jest dostepne w internecie. Sprawa ta dodała też odwagi pokrzywdzonym w innych krajach, także i w Polsce.
Ewelina od 6 roku życia była w rodzinie Świadków Jehowy. Od dziecka nie pamięta innego życia. Z ojcem nie czuła żadnej więzi. – To był dla mnie obcy człowiek. Od początku tylko się go bałam. Czy było dla mnie coś nienaturalnego w tym, co robił? Jako mała dziewczynka miała poczucie tajemnicy. On mówił, że ojcowie tak muszą robić, że to taki nasz sekret. Później… to chyba myślałam, że nie mam wyjścia, że tak musi być. A jak masz 10 – 11 lat to czujesz, że to nie jest jednak normalne, co ojciec ci robi i zaczynasz się buntować, ale ten bunt jest skrzętnie tłamszony: „Jak powiesz, to twoja matka tego nie wytrzyma” – słyszysz i w pewnym momencie się zamykasz. Nie miałam siły psychicznej, żeby wtedy zareagować. Mój ojciec nie jest jedynym pedofilem, którego spotkałam. Drugi z nich był ojcem trojga dzieci, w tym dwóch dziewczynek, przyjaciel naszego domu. To z nim pewnego dnia poszłam do służby, czyli chodziliśmy od domu do domu. Zaczął się do mnie przystawiać, włożył moją rękę do swojej kieszeni, powtarzał, jaka jestem piękna, dotykał mnie, głaskał, a w aucie zaczął mnie całować… Miałam wtedy 14 lat. Później się dowiedziałam, że molestował niepełnosprawną dziewczynkę, o tym mówiono.
Temat jest wciąż świeży i niewyjaśniony do końca, takich ofiar jak Ewelina może być bardzo wiele. Ofiar, które milczą i cierpią, bo tego wymaga ich wyznanie, a propaganda Strażnicy wmawia im, że tego oczekuje od nich Bóg.
Opracowała Elżbieta Dziurkowska https://przerywamymilczenie.pl/artykuly/pedofilia-wsrod-swiadkow-jehowy.html
Dezerterze – co Ty NA TO?
Dezerter – dlaczego starszymi zboru w twej sekcie mogą być tylko i wyłącznie mężczyźni?
Świadkowie Jehowy a wykształcenie
W tym artykule poruszymy jedną z ważniejszych kwestii w życiu człowieka i podejścia do niej liderów świadków Jehowy (śJ), a jedną z ważniejszych dlatego, że od niej przecież zależy to, jak wygląda całe życie dorosłego świadka Jehowy.
Chodzi o kwestię wykształcenia. Zbadajmy, jak to wygląda w tym ugrupowaniu religijnym. Na wstępie, zaczniemy od cytatów z ich literatury na ten właśnie temat.
Oficjalne stanowisko Ciała Kierowniczego Towarzystwa Strażnica
W Strażnicy z roku 1972 (XCIII) numer 19 s. 11 napisano tak: „Wszelkim świeckim karierom wkrótce będzie położony kres. Po co więc nasza młodzież miałaby dzisiaj interesować się „wyższymi studiami” i przygotowywać się do przyszłości, która się wcale nie urzeczywistni? Wyższe uczelnie i tak już stoją na krawędzi chaosu. Najważniejsze wiadomości potrzebne w życiu można zdobyć pilną nauką w szkole średniej, a ponadto Jehowa przez swoją organizację udostępnia nam najwyższe wykształcenie, przygotowujące do radosnego pełnienia pełnoczasowej służby Bożej, która będzie trwała bez końca. (…) Młodzi, a także starsi – unikajcie lektur, programów telewizyjnych i filmów propagujących świecki tryb życia.”
W innej Strażnicy z roku 1986 nr 8, s.12, ak.12 tak pisano: „Seks, przyjemności, bogactwo oraz wyższe wykształcenie są dziś dla wielu przedmiotem bałwochwalczej czci równej uwielbieniu, jakim starożytni mieszkańcy Efezu otaczali Artemidę (Mat.6:24; Ef.3-5; Fil. 3:19) Jednakże ci, którzy rozwijają w sobie pobożność, idą lepszą drogą życiową.
„Przypatruję się dziewczętom i chłopcom, z którymi się zadawałam, zanim zaczęłam studiować Biblię”, opowiada pewna 24-letnia chrześcijanka, „Połowa z nich jest w więzieniu, większość zażywa narkotyki, a sporo dziewcząt ma nieślubne dzieci. Dostali się w bagno. Niektórzy nawet już nie żyją. Niezmiernie cieszę się, że gdy pomyślę o moim życiu, mam się czym poszczycić.” Inni młodzi chrześcijanie całkowicie się z tym zgadzają.”
Jak to, co propagują ma się do rzeczywistości?
Powyższe dwa cytaty dokładnie nakreślają wieloletnią politykę doktrynalną Towarzystwa Strażnica (TS) w kwestii kształcenia się. I choć cytaty są z przed wielu lat, do dziś linia takiego podejścia do tej kwestii nie zmieniła się.
CDN
C.D.
Sprawdźmy wytyczne bliżej naszych czasów:
„4) Teraz jest czas, żeby ci, którzy pokładają ufność w świeckim wykształceniu, dobrach materialnych albo w ludzkich instytucjach, zmienili swój sposób myślenia.”
Strażnica z 15 listopada 2013 roku, s.20, ak. 17:
„Nauczyciele, pedagodzy szkolni i inne osoby, mogą cię zachęcać do zdobycia wyższego wykształcenia i robienia kariery zawodowej.
Jednak Jehowa radzi, żebyś obrał inny kierunek.”
Strażnica z grudnia 2018 roku s.19
W związku z nieustannie zbliżającym się końcem świata i Armagedonem, Ciało Kierownicze (CK) świadków Jehowy skutecznie zniechęca wyznawców do zdobywania wyższego wykształcenia, stosuje różną presję i naciski w kierunku młodzieży, rodziców, na rzecz nauki zawodów „przydatnych” w nowym świecie, a więc w raju na ziemi przez nich głoszonym. Wyższe wykształcenie jest wręcz potępiane przez przywódców sekty i jak mogliśmy przeczytać już w cytowanych fragmentach Strażnicy z roku 1986, przedstawiane w jak najgorszym świetle. Takie podejście do sprawy powoduje, że świadkowie Jehowy są grupą społeczną o jednym z najniższych odsetek osób posiadających wyższe wykształcenie i wśród wyznań plasują się na końcowych miejscach pod tym względem.
CDN
C.D.
Liczne artykuły i filmy propagandowe tworzone i rozpowszechniane przez „osoby trzymające władzę” (CK) w tym ugrupowaniu, proponują młodym świadkom „zmierzanie do celów przysparzających czci Bogu”.
Manipulacja polega na tym, że w tym momencie odmawia się młodym ludziom dążeń do własnego rozwoju, zadowolenia z wykonywanej pracy i w ostatecznym rezultacie do godziwego życia. A ktoś, kto chciałby poświęcić czas na kształcenie się, jest postrzegany jako człowiek małej wiary, z kolei ci, którzy radzą swoim bliskim czy przyjaciołom rozsądne postępowanie, są kreowani na wrogów prawdziwej pobożności. Myślenie o podjęciu studiów jest traktowane jak pokusa, która młodych ludzi ma oderwać od Boga, czyli prowadzenia pobożnego życia według dyrektyw CK.
Młodzi, którzy ślepo słuchają ich rad ponoszą długofalowe konsekwencje. Podejmują błędne decyzje, które rzutują na całe życie. Potem gdy dorosną, często zmagają się z poczuciem zmarnowanego życia. W ten sposób CK świadków Jehowy, swoimi doktrynami wychowuje kolejne pokolenia straszone zbliżającym się końcem świata i Armagedonem.
Bardzo wielu młodych, szczególnie tych wychowywanych od „niemowlęctwa” w rodzinach świadków, ślepo słucha takich zachęt i poprzestaje na edukacji na poziomie zdobywania praktycznego zawodu, którą już obecnie TS pod przykrywką dzieła Bożego, skrupulatnie wykorzystuje jako ochotniczą i darmową siłę roboczą do realizacji swoich projektów budowlanych zakrojonych na szeroką skalę, budowania obiektów wielbienia Jehowy, by po jakimś czasie z ogromnym zyskiem sprzedać je, tak jak to ma obecnie miejsce ze sprzedażą wielu sal królestwa i sal zgromadzeń na całym świecie.
Pomysł na życie propagowany przez CK świadków Jehowy, by zmierzać do celów duchowych, rezygnując z normalnego życia, został bardzo boleśnie i niepomyślnie zweryfikowany w latach 70-tych XX wieku. Histeria roku 1975 doprowadziła wielu szczerych ludzi, którzy uwierzyli w nowy porządek propagowany przez tę religię, do tego, że rezygnowali oni z dobrej pracy, zabezpieczenia finansowego i kształcenia się. Normalne ludzkie dążenia są przedstawiane jako wyraz materializmu i niedojrzałości duchowej, a żaden śJ nie chce być tak postrzegany.
CDN
C.D.
Miliony szeregowych świadków, ciągle zachęca się do prowadzenia skromnego życia, gdy tymczasem „kanał łączności” jakim jest CK, żyje w wygodzie i luksusach, oderwany całkowicie od problemów codziennej rzeczywistości, a liczną rzeszę „owiec” ciągle nawołuje się do wielu wyrzeczeń „ze względu na Królestwo”, odmawiając m.in., wyboru pójścia na studia.
I żeby było śmieszniej, CK w tym względzie uprawia ogromną hipokryzję, ponieważ okazuje się, że TS finansowało studia prawnicze swoim prawnikom, co zeznali ich prawnicy przesłuchiwani w sprawie o pedofilię w Australii przed Państwową Komisją Królewską, potwierdzając ten fakt. Zbory skutecznie zniechęca się do podejmowania nauki w uczelniach wyższych, ale Biuro Główne na własne cele wysyłało ludzi korzystając z datków mas, które się do tego zniechęca.
Po latach takiej indoktrynacji widać smutne efekty tych rad. Ludzie kończą edukację na zawodówkach, albo kiepskim średnim, często bez matury, później mają tylko pracę za niewielkie pieniądze, a życie staje się ciągłą walką o to, jak przeżyć od pierwszego do pierwszego.
A na starość, TS nie potrzebuje ludzi zmęczonych życiem, którzy w młodości zawierzyli doktrynom o rychłym końcu świata, raju na ziemi i tym, że „wszelkim świeckim karierom zostanie położony kres”. Te ich proroctwa wypowiedziane w XX w., jak widać, nie mają swojego spełnienia. Kłamali i nadal okłamują sporą rzeszę młodych i ich rodziców, całe nowe pokolenia, by osiągać swoje cele. To trwa już całe dziesięciolecia i ta manipulacja nie ma końca.
Organizacja Watch Tower (Stowarzyszenie Strażnica) to energetyczny wampir, potężna toksyczna machina, która wysysa ze swoich ofiar, wszystko, co najlepsze. Młodzi, łapiący się na bzdury o szkodliwości wyższego wykształcenia, mają złamane życie, wiele niewykorzystanych szans, bez odwrotu, tylko po to, by mała, wybrana grupa ludzi, już dziś, nie czekając na raj na ziemi opływała w luksusy.
„Trzeba mieć wiarę, żeby zrezygnować z wyższego wykształcenia”
W roku 2016 jeden z członków CK ŚJ – Anthony Morris – wygłosił przemówienie na temat wyższego wykształcenia (kliknij tutaj by obejrzeć). W tym wykładzie, ów mówca w doskonały sposób swoją retoryką, wzbudza poczucie winy w rodzicach, którzy pozwalają swoim pociechom podjąć kształcenie się na wyższych uczelniach, ubolewa nad tym, że studiujące dzieci po kilku tygodniach lub miesiącach zaczynają opuszczać zebrania, a niedługo później zupełnie znikają z horyzontu zboru. Nie została też pominięta kwestia tego, że inteligentni i elokwentni profesorowie uniwersyteccy, będą próbowali przekształcić sposób myślenia dziecka i dziecko może stać się osobą w ogóle nie wierzącą w Boga. Takie teksty mają silnie oddziaływać na mocno wierzących rodziców, by nie posyłały swoich latorośli na studia.
CDN
C.D.
A. Morris w tym przemówieniu jasno stwierdził, że na całym świecie potrzeba teraz przede wszystkim osób znających się na budownictwie (bowiem od wielu lat w tym ugrupowaniu trwa boom budowania, rozbudowywania i remontowania wszelkich sal spotkań członków kultu, biur i budynków zarządów za pieniądze wiernych, które to budynki potem są sprzedawane z ogromnym zyskiem, a finanse przepadają w przepastnych zakamarkach TS). Nie omieszkał stwierdzić, że wiara jest niezbędna do tego, by zrezygnować z wyższego wykształcenia. Przytoczono przykład brata, który studiował na uniwersytecie, który przyrównał otocznie na studiach do płonącego domu, z którego, nawet jeśli zdążymy wyjść, to przesiąkniemy swędem dymu. A wiec, jakby „filozofią tego świata.” Do rodziców skierował przesłanie, że to od ich wiary będzie zależało, czy swoje dziecko wyślą na uniwersytet. To nagranie jest dobitnym dowodem, że CK nadal kontynuuję swoją bezwzględną politykę nie posyłania dzieci na wyższe uczelnie i nie zamierza tego zmieniać.
Film, propagandowo jest bardzo dobrze zrobiony. Dobrze przekonuje przede wszystkim rodziców, że studia to samo zło. Zdobywanie świeckiej mądrości, wg TS, to też samo zło. Studia to też złe towarzystwo, które sprowadza na manowce. Przemówienie Anthony’ego Morrisa propaguje wychowywanie całych pokoleń ludzi bez przyszłości. W perspektywie czasowej, to nie jest zmartwienie CK, tylko rodziców. Bo takie dziecko bardzo często, mieszka z rodzicami, nie ma wykształcenia, nie ma pracy, ani na starość dobrej emerytury, nie może też być dobrym wsparciem finansowym dla nich, bo samo jest nieporadne i samo go potrzebuje.
Młodzi ludzie wybierający się na studia, mają większy dostęp do wiedzy, nie są tylko ograniczeni do propagandowych informacji zawartych w literaturze CK i po bliższym poznaniu i spojrzeniu z pewnego dystansu, odkrywają, czym ta religia jest i wielu młodych nie decyduje się na przyjęcie chrztu, czego CK bardzo oczekuje. Liczne zakazy sprawiają też, że dzieci śJ nie integrują się z kolegami z klasy, co sprawia, że czują się wyobcowane, wyalienowane z życia środowiska szkolnego. Od najmłodszych lat, nie biorą udziału w zabawach i uroczystościach klasowych. Ich jedynym zadaniem oprócz nauki, jest „dawanie świadectwa” o swojej wierze i głoszenie nauk Strażnicy kolegom i nauczycielom.
Zakaz przyjaźni z ludźmi ze świata, czyli wszystkimi, którzy nie są świadkami Jehowy, powoduje, że nie nawiązują głębszych relacji z innymi. Nie mają normalnego dzieciństwa. Muszą być takimi małymi – dorosłymi, pokonywać swój lęk, być odważnymi na każdym kroku, od pierwszych chwil pobytu w szkołach, a nawet jeszcze wcześniej, jeśli chodzi do przedszkola. Od najmłodszych też lat są przygotowywane do udziału w zebraniach, też muszą chodzić z rodzicami do tzw., służby’, czyli odwiedzać ludzi w ich domach i głosić im świadkowe nauki o Bogu. Brać udział w zebraniach, zgromadzeniach i innych zajęciach teokratycznych, których kierunek określa CK. Indoktrynacja w tej kwestii jest kompletna. Dziecko wychowywane w rodzinie śJ, nie ma szans na samodzielne decyzje, chyba że się zbuntuje i wtedy idzie własną drogą, bo takie przypadki też się zdarzają. Trafiają się też rozsądni rodzice, którzy pomimo nacisków władzy zborowej, posyłają dzieci na studia, ale jest to bardzo źle postrzegane. Ojcowie takich rodzin, jeśli są tzw., starszymi czy sługami pomocniczymi w zborze (odpowiednik księdza i diakona w KK) tracą te przywileje, bo według wymogów CK nie mogą popierać dzieci w tym kierunku (zob. list do starszych zboru z 6 marca 2012).
CDN
Podsumowanie
Skuteczne zniechęcanie do wyższego wykształcenia, to tylko jeden z wielu bardzo niebezpiecznych elementów tej destrukcyjnej (szkodliwej) sekty. Studia, to największy wróg Watch Tower.
Od wieków wiadomo jest, że niewykształconym, ociemniałym ludem łatwiej się kieruje i manipuluje. To jest jeden z głównych powodów, dla których przywódcy świadków Jehowy tak dbają o to, by nie mieć wykształconej armii ludzi, by skutecznie zniechęcać młodzież świadkowską do podejmowania studiów. Mocno się indoktrynuje rodziców, by zniechęcali swoje dzieci do zdobywania wyższego wykształcenia, poprzestawali na minimalnych potrzebach, a resztę czasu poświęcali temu kultowi i robią to z bardzo dobrym skutkiem.
CK jest świadome i bardzo dobrze wie, że odpowiednie wykształcenie pomaga ustrzec się manipulacji, ułatwia rozeznanie, uczy wnikliwości i wyciągania rozsądnych wniosków, a te cechy paradoksalnie, nie są na rękę przywódcom Towarzystwa. „Kanał łączności” (CK), już dawno zdobył swój Mount Everest swojej hipokryzji. Takimi dyrektywami totalnie rozwala ludziom życie i jeszcze do tego jest całkowicie bezkarne. CK potępia wyższe wykształcenie, bo ludzie wykształceni, myślący, ambitni, inteligentni są dla nich ogromnym zagrożeniem. Nie są ślepo podporządkowani. Nie zgadzają się na wszystko, a to jest bardzo niewygodne w tej sekcie, gdzie wymaga się całkowitego posłuszeństwa i uległości.
Polityka organizacji w kwestii wzbudzania ogromnego poczucia winy i tworzenia wyrzutów sumienia z powodu podejmowania nauki na uczelniach wyższych doskonale wpisuje się w całościową politykę manipulacji i kontroli wszystkich członków organizacji.
Młodzi ludzie, którzy to czytacie
Dajcie sobie prawo do solidnego wykształcenia, do decydowania o swoim życiu, do wyboru kariery i drogi życiowej. Prawo do nauki, to jedno z podstawowych praw człowieka. Jego istnienie jest usankcjonowane przez art. 26 Powszechnej Deklaracji Praw Człowieka. Tylko kult fanatyczny może żądać rezygnacji ze zdobywania wykształcenia przez swoich członków, do którego bez zwątpienia świadków Jehowy śmiało można zaliczyć.
Wyższe wykształcenie nie daje gwarancji na dobrą pracę ale daje na nią ogromną szansę w dzisiejszych czasach. Świat pracy potrzebuje specjalistów, fachowców, biegłych oraz naukowców wszelkiej maści, nie ludzi ograniczających się do sprzątania sal królestwa i mycia okien w cudzych firmach. CK, zniechęca do kształcenia się, ale samo nie stroni od korzystania z tego dobrodziejstwa ludzkości i postępu, który następuje dzięki temu, że istnieją wykształceni ludzie. Przykładem tego jest na przykład bardzo dobrze wyposażone studio nagrań TV Broadcasting, którą CK, bardzo dobrze posługuje się do indoktrynowania szeregowych śJ. Tego nie wykonują prości, niewykształceni ludzie.
Linia doktryn Strażnicy ma na celu wychowanie nowych pokoleń, które nie potrafiąc samodzielnie myśleć podporządkują całe swoje życie przywódcom organizacji. Studia przedstawia się wyłącznie w czarnych barwach, wymienia się wyłącznie zagrożenia, nie wspominając ani słowem o korzyściach płynących ze zdobycia wiedzy. CK w sposób perfidny odbiera szanse młodym ludziom na lżejsze i łatwiejsze życie.
Młodzi, zdolni i myślący Świadkowie Jehowy!
Nie dajcie sobie wmówić, że Wasze kształcenie ma ograniczać się do wykształcenia w ramach tej proponowanej przez nich, chorej teokracji poprzez indoktrynacyjne zebrania, rodzinne wielbienie, zgromadzenia, kongresy i mocno rozbudowany serwis oficjalnej strony jw.org. I że tylko zmierzanie do celów przysparzających czci Bogu ma w życiu sens i cel, co w przypadku tego kultu, ogranicza się w ogromnej mierze do pozyskiwania nowych członków tej grupy religijnej, którymi się będzie łatwo manipulowało. Z takim podejściem, będziecie spełniali cele CK i TS, budując dla nich nowy, stały elektorat niewykształconych ludzi, popierający ślepo ich iluzoryczną wizję raju na ziemi z czekaniem bez końca na zapowiadany wielokrotnie koniec świata i jego punkt kulminacyjny, Armagedon, a o to właśnie im chodzi.
Niech Wasze życie, stanie się Waszą własnością i w dużej mierze, zależy to od Waszych rozsądnych decyzji dotyczących Waszego wykształcenia.
Teksty Ciała Kierowniczego Świadków Jehowy typu:„Rozwijanie swoich talentów to martwe uczynki”
(Strażnica z 15.04.2006 r., art.: „Niech wasze ręce będą silne” ak. 13-14)
…powinny trafić do więzienia razem z CK. Takie zdania, to hańba, w świecie, gdzie następuje rozwój właśnie dzięki nauce i wykształconym ludziom. Ktoś pięknie podsumował to, co w kwestii wyższego wykształcenia propaguje CK: „Na końcu powinna być dodatkowa minuta ciszy po śmierci zdrowego rozsądku”
Bardzo trafna puenta, tego co w kwestii wykształcenia oferuje CK śJ.
Nie wyszlibyśmy z epoki kamienia łupanego, gdyby nie odpowiednia edukacja i rozwój świata nauki w każdym możliwym kierunku. W życiu, można pracować mozolnie dla samej pracy, ale bardzo dobrze jest mieć dodatkowo przyjemność z wykonywania jej i dobre pieniądze. Robienia tego, co się lubi, kocha i co może być spełnieniem naszych talentów, ambicji i marzeń. Zdobycie wyższego wykształcenia na pewno w dużej mierze pozwala osiągnąć ten cel, by prowadzić satysfakcjonujące nas życie. A tego wszystkiego, poprzez średniowieczną, indoktrynacyjną linię CK śJ, młodzi, zdolni ludzie są pozbawiani, nieodwracalnie. To niewybaczalny grzech przeciwko młodym, zdolnym pokoleniom.
Opracowała: Estera (https://przerywamymilczenie.pl/artykuly/wyzsze-wyksztalcenie.html)
I co Ty NA TO, Dezerterze?
Nie ważne czy to kościół czy cerkiew – istotny jest co Rosjanie chcieli przekazać i sposób w jaki to uczynili .
kaesjot 5 CZERWCA 2022 16:12
Wiem, ale lepiej gdyby wybrali za cel np. pomnik Bandery w zawsze polskim Lwowie.
kalvarya01
Zauważ różnice w podejściu pomiędzy wschodem, południem a zachodem.
Studiowanie na zachodzie staje się ekstremalnie drogie, a więc dostępne dla wąskiej kasty dzici bogatych, bądź długi studenckie ciągnace sie dziesiecioleciami.
Chiny czy nasza ulubiona AS funduje stypendia w ilosci setek, czy dziesiątek tysięcy, dla najbardziej zdolnych, na kierunki inżynierskie, scisłe.
Która koncepcja kształcenia kadr wygra w długiej perspektywie?
A co do ŚJ….
Ograniczenie poziomu wiedzy owieczek ma sens.
Łatwiej się je strzyże.
Dokładnie to samo dotyczy Zachodu.
Oduczenie logicznego myslenia, pozbawienie wiedzy, nauczenie kierowania się emocjami, to dażenie do „zbaranienia” populacji.
Czy ma to sens?
Długookresowo jest zabójcze.
Ale krótkookresowo zapewnia władzę i profity.
Obecnie jestesmy chyba na etapie ujawniania się skutków takiej polityki prowadzonej przez jakieś 50 lat.
Skutki wymykają się spod kontroli, owocując durniami na stanowiskach decyzyjnych.
wiesiek59 5 CZERWCA 2022 16:29
Pytasz się, która koncepcja kształcenia kadr wygra w długiej perspektywie? Wiadomo, że NIE zachodnia.
I Zgoda, że ograniczenie poziomu wiedzy owieczek (właściwie baranów) ma sens, gdyż łatwiej się je strzyże i że dokładnie to samo dotyczy Zachodu. I zgoda, że długookresowo jest to zabójcze, ale krótkookresowo zapewnia władzę i profity i że obecnie jesteśmy na etapie ujawniania się skutków takiej krótkowzrocznej polityki, z horyzontem czasowym do następnych wyborów, a więc kilkuletnim, a prowadzonej przez Zachód już jakieś 50 lat. Jej skutki wymykają się więc spod kontroli, owocując durniami na stanowiskach decyzyjnych – od Warszawy do Waszyngtonu, od Rejkjawiku po Rzym.
wiesiek59 5 CZERWCA 2022 16:29
Efekty polityki Jehowitów są widoczne. Taki Dezerter nie zna nawet łaciny, o grece czy hebrajskim już nie wspominając, a uważa się, w swej „błogosławionej” głupocie, za eksperta w dziedzinie biblistyki.
kalvarya01
5 CZERWCA 2022
17:08
Nawet profesura z biblistyki, hadisów, tałmudu, nie grozi niczym.
Poza bezsensownym trafieniem tysięcy godzin na rzeczy nieprzydatne.
Choc można z tego nieźle żyć.
Groxne jest odciągnięcie pewnej ograniczonej puli umysłów od rozwiązywania realnych problemów swiata.
Intelekt 4 odchylenia standardowego trwoniony jest na abstrakcyjne problemy.
Najtęzsze umysły zatrudniane sa w bankach, czy innych instytucjach finansowych, nie produkujacych niczego- poza długiem w postaci instrumentów finansowych.
Te umysły byc może pozwoliłyby nam przekroczyć technologie wieku pary, rakiet chemicznych, silników spalinowych.
Ale, w tych dziedzinach za mało PŁACĄ.
Wiesiek59 5 CZERWCA 2022 17:26
Racja. Najtęższe umysły zatrudniane są dziś w bankach, czy też w innych instytucjach finansowych, nieprodukujących niczego – poza długiem w postaci tzw. instrumentów finansowych. Ale sofony nie pozwalają nam zatrudnić ich w innych dziedzinach, a więc ludzkość skazana jest na zagładę, ale inną niż ta przepowiadana przez Jehowitów.
kalvarya01
5 CZERWCA 2022
17:32
POPRAWKA.
Nie LUDZKOŚĆ, tylko Zachód stawiający nie na tego konia który wygra.
Ps.
Świetne sceny batalistyczne od 1 h.
Nie tylko Hollywood robi dobre filmy.
https://www.youtube.com/watch?v=eNwozWTZk6s
Ps.2.
Utkwiła mi w pamięci definicja:
„Polityk to człowiek który dla zaspokojenie Własnych ambicji, poswięci KAŻDĄ ilość CUDZYCH dzieci”.
Jakie to adekwatne do obecnej rzeczywistości….
Wiesiek59 5 CZERWCA 2022 17:56
Obawiam się, że Zachód, w tym szczególnie USA, widząc, że jego dni są policzone i tym samym jego panowanie jest skończone, wywoła III wojnę światową, nie mając już nic do stracenia, na zasadzie „po nas choćby potop”, bo taka jest ta zdegenerowana moralność i ideologia owego Zachodu. I zgoda co do reszty.
mfizyk 30 MAJA 2022 0:33
Jeśli 1,1 = 2, to 1,1 > 2 i jednocześnie 1,1 < 2.
Wracając do tematu tego wątku – czym jest życie? Według Wikipedii, jest to właściwość pewnych układów fizycznych (organizmów – ob.), w których zachodzą procesy życiowe (ob.).
Organizm – istota żywa charakteryzująca się procesami życiowymi (ob.).
Procesy życiowe, czynności życiowe – czynności wspólne dla istot żywych (ob.).
Przypomina mi to definicję sepulek według „Encyklopedii Kosmicznej” pod red. prof. Tarantogi:
Sepulka – l.mn. sepulki, odgrywający doniosłą rolę element cywilizacji Ardrytów (ob.) z planety Enteropii (ob.). Ob. sepulkaria.
Sepulkaria – l.poj. sepulkarium, obiekty służące do sepulenia (ob.).
Sepulenie – czynność Ardrytów (ob.) z planety Enteropii (ob.). Ob. sepulki.
(Stanisław Lem „Dzienniki gwiazdowe”, Podróż czternasta)
Banderowcy zastrzeli swojego negocjatora rozmów w Mińsku … Tak sobie myślę prywatnie … a tzw. zachodnia cywilizacja milczy … przyjęła z pokorą fakt jako endemiczne traktowanie posłuszeństwa … majtki Nawalnego w tle …
Z NYT:
Rosja bombarduje Kijów
Co najmniej pięć pocisków rakietowych uderzyło wczoraj w Kijów. To pierwsze rosyjskie uderzenie na stolicę Ukrainy od ponad miesiąca. Rosja podała, że pociski zniszczyły czołgi i pojazdy opancerzone dostarczone przez wschodnioeuropejskich sojuszników Ukrainy. Co najmniej jedna osoba została ranna, poinformowali urzędnicy.
Atak ten nastąpił po tym, jak prezydent Rosji, Władimir Putin, ostrzegł, że Moskwa uderzy na cele, których do tej pory unikała, jeśli państwa zachodnie zaczną dostarczać Ukrainie pociski większego zasięgu.
Przetłumaczono z http://www.DeepL.com/Translator (wersja darmowa z moimi dodatkami)
Też z NYT:
Złe opcje Bidena na obniżenie cen ropy
Zaplanowane na lato spotkanie prezydenta Bidena z Mohammedem bin Salmanem, księciem koronnym Arabii Saudyjskiej, to tylko najnowszy znak, że ropa naftowa znów odzyskała centralne miejsce w geopolityce.
Biden ma niewiele narzędzi, aby obniżyć ceny na stacjach benzynowych, zwłaszcza gdy Rosja, jeden z największych producentów energii na świecie, rozpoczęła wojnę ze swym mniejszym sąsiadem. Dwa inne kraje produkujące ropę, które mogłyby zwiększyć wydobycie – Iran i Wenezuela – zostały w dużej mierze odcięte od światowego rynku przez zachodnie sankcje.
Stany Zjednoczone są największym producentem ropy naftowej i gazu ziemnego na świecie, ale dostarczają tylko około 12% światowych dostaw ropy. W zależności od wydarzeń na całym świecie cena ropy może wzrosnąć lub spaść. A kiedy ceny paliw rosną, konsumenci mogą zwrócić się przeciwko prezydentom, którzy nie chcą lub nie potrafią ich obniżyć.
Analiza: „Prezydent musi próbować” – powiedział Bill Richardson, sekretarz ds. energii w administracji Clintona. „Niestety, istnieją tylko złe opcje. A wszelkie alternatywne opcje są prawdopodobnie gorsze niż poproszenie Saudyjczyków o zwiększenie produkcji.” Oto cała moralność Zachodu, Mr. Mr. PAK4, MFizyk etc. etc.
Przetłumaczono przy użyciu Deepl (wersja darmowa z moimi dodatkami)
Analiza NYT: „Prezydent musi próbować” – powiedział Bill Richardson, sekretarz ds. energii w administracji Clintona. „Niestety, są tylko złe opcje. A wszelkie alternatywne opcje są prawdopodobnie gorsze niż poproszenie Saudyjczyków o zwiększenie produkcji”.
Mój komentarz: oto cała moralność Zachodu w pigułce – jak wtedy, kiedy prezydent USA, niejaki Roosevelt (FDR) wygłosił często cytowaną uwagę o dyktatorze Nikaragui, niejakim Anastasio Somozie: „Somoza może i jest sukinsynem, ale to nasz sukinsyn” („“Somoza may be a son of a bitch, but he’s our son of a bitch.”)
I co na to Pak4, Mfizyk etc.?
Girkin znowu mowi:
„Putina, drodzy przyjaciele, czekają dwa warianty. Może skończyć jak Milošewić w trybunale haskim. A może jednak rozszarpie go tłum, jak Kaddafiego.”
Jako czlonek tej mafii pewno wie co mowi 🙂
mfizyk 6 CZERWCA 2022 11:18
Biden ucieknie zaś przed karzącą ręką sprawiedliwości na łono Abrahama i to szybko. Tak jak np. syjonistyczni zbrodniarze typu Dajana, Begina czy Szarona.
@mfizyk:
Ja życzę Rosjanom ich wariantu Bukaresztu ’89 — jeśli tego nie zrobią ludzie ich własnych służb specjalnych, to może powstać toksyczna legenda wielkiego Putina i noża w plecy wbitego przez liberałów, lewaków i Zachód.
Ale cóż. Dodam tylko, że jak wróciłem z Beskidów, zerknąłem, zobaczyłem te odmęty, to stwierdziłem, żeby Nasi Koledzy się tak pięknie sami kompromitują, że nie trzeba niczego dodawać.
@ kalvarya01
6 CZERWCA 2022
14:47
No coz, Trumpa nie byloby szkoda. Bidena juz tak. Ale nasz system sie z tym poradzi 🙂
Ale nie daj Boze taki „wuc” jak Putin zemrze. Co za tragedia. Wiec niech Putin zyje wiecznie… na pohybel swojej bandy 🙂
@ PAK4
6 CZERWCA 2022
19:17
„…to stwierdziłem, żeby Nasi Koledzy się tak pięknie sami kompromitują…”
Tak, wystarczy ich troche podpuscic i juz sie ma ucieche 🙂
Chyba musze to sobie na jakis czas odpuscic. Bo sie jeszcze uzaleznie 😉
Putin … wszelka władza od boga pochodzi … Tak sobie myślę prywatnie … papież z pokorą przyjmuje ten fakt …
PAK4 6 CZERWCA 2022 19:17
Zabraklo ci, intelektualny biedaku, argumentów ad rem… 🙁
PAK4 6 CZERWCA 2022 19:17
Rosjanie to NIE jest rumuńska dzicz.