Trochę siara
Nieczęsto i niezbyt dogłębnie piszę o chemii. Czasem jednak mam z nią do czynienia – i nie mam tu na myśli stwierdzeń, że w „jedzeniu sama chemia” czy zakupów w dziale „chemia domowa”. Trochę czasu spędziłem w laboratorium chemicznym już po studiach, a moje osobiste doświadczenia ze stężonym kwasem siarkowym zaciąganym pipetą kładą kłam stwierdzeniom, jakoby szkliwo zębów w ogóle się nie regenerowało.
Wyniki analiz chemicznych widuję nie we własnych notatkach, a najczęściej w tabelach dotyczących składu wody w rzekach i jeziorach. Skoro już o kwasie siarkowym zagaiłem – w tych tabelach czasem pojawiają się siarczany (o tym, że mogą się pojawiać w wodzie jako efekt uboczny walki ze smogiem, kiedyś pisałem), a znacznie rzadziej siarkowodór.
Znacznie rzadziej, bo w wodach tak naprawdę nie ma go tak dużo i nie jest monitorowany. Monitoruje się go dopiero, gdy stwierdzi się brak tlenu. Ma to oczywiście sens, bo gdy w wodzie są zauważalne ilości tlenu, siarka z siarkowodoru utlenia się, więc jest go mało. (Oczywiście dlatego, że zwykle przeglądam dane z wód śródlądowych, w Bałtyku stref głębin beztlenowych, czyli z siarkowodorem, jest więcej).
Siarkowodór, rozpuszczając się w wodzie, tworzy słaby kwas. Rozpuszczanie w wodzie polega po części na rozcieńczaniu, gdy cząsteczki substancji rozpuszczonej pozostają w swojej postaci, a po części na hydrolizie, gdy woda rozrywa cząsteczki na jony. Gazy takie jak tlen czy azot praktycznie nie hydrolizują, a gazy będące tzw. bezwodnikami silnych kwasów, jak trójtlenek siarki, hydrolizują silnie i rozpadają się na kationy wodorowe (czyli protony) i aniony – tu siarczanowe. (Z tymi wolnymi protonami to oczywiście uproszczenie, bo nie pływają swobodnie, tylko wiążą się z wodą).
Siarkowodór czy dwutlenek węgla są bezwodnikami słabych kwasów i trochę ulegają hydrolizie, a trochę nie. Zależy to także od odczynu rozpuszczającej wody. Przy pH 5-6 siarkowodór dysocjuje słabo, przy pH czystej wody wynoszącym 7 – mniej więcej połowa siarkowodoru pozostaje w formie H2S, a połowa w postaci jonu HS–. Przy pH 8 postać H2S już praktycznie nie występuje, dominuje HS–, a zaczyna pojawiać się jon siarczkowy S2-, który według podręczników w wodzie o pH powyżej 10 praktycznie jest już wyłączną postacią rozpuszczoną.
Czyli jeżeli potrzebujemy jonu siarczkowego, najlepiej go uzyskać z silnie alkalicznego roztworu. Wygląda to tak:
HS– + OH– <=> S2- + H2O
Jon siarczkowy jest tu rozpuszczony w wodzie. W chemii często zapisuje się to jako S2-(aq). Taki zapis znajdziemy w podręcznikach, a przede wszystkim w tabelach z parametrami termodynamicznymi stosowanymi w przemyśle chemicznym. Siarczki to ważne związki i dobrze rozumieć dokładnie dynamikę ich reakcji. Siarka w tej postaci może być cennym surowcem lub groźnym zanieczyszczeniem. Ile trzeba włożyć energii i jakich proporcji odczynników użyć – to kwestia finansowa.
Tymczasem już kilkadziesiąt lat temu przynajmniej jeden podręcznik bardziej pochylający się nad samym jonem siarczkowym twierdził, że w klasycznej postaci, czyli S2-(aq), jest praktycznie nie do stwierdzenia, choć jego autor skwitował to jako mało ważny fakt. Jonów, zwłaszcza tak małych, nie obserwuje się ot tak pod mikroskopem (tzn. można, ale koszty są duże), a nie każdy sprzęt analityczny można zastosować w silnie zasadowym środowisku. Niemniej kolejne badania pokazywały, że nawet w nasyconym roztworze wodorotlenku sodowego wciąż znajdują się jony HS– – wbrew podręcznikowym wykresom.
W związku z tym grupa australijskich chemików postanowiła użyć kolejnych metod analitycznych, konkretnie spektroskopii ramanowskiej, by potwierdzić pojawianie się wodnego jonu siarczkowego w tak silnej zasadzie. Niestety, nie udało się. Oczywiście, analityka chemiczna zwykle polega na analizie pewnych śladów, a nie na konkretnym uchwyceniu konkretnych cząsteczek, ale z ich analizy najbardziej prawdopodobny obraz reakcji wygląda nie tak, jak podałem wyżej, lecz tak:
HS– + OH– + Na+ <=> NaS– + H2O
Czyli atom siarki, który mógłby tworzyć jon siarczkowy, od razu jest przechwytywany przez atom sodu.
Oczywiście, nieistnienia wodnego jonu siarczkowego nie da się udowodnić, podobnie jak nie da się udowodnić nieistnienia Boga, krasnoludków czy czajniczka Russela. Mimo to badacze w opublikowanej dwa lata temu pracy postulują, by w praktyce taki wniosek przyjąć (przynajmniej co do jonu, o innych bytach, które wymieniłem, się nie wypowiadają) i usunąć go z podręczników i baz danych. Ich zdaniem utrzymywanie go tam jest, mówiąc językiem młodzieżowym (przynajmniej z jakiegoś okresu), trochę siarą.
Piotr Panek
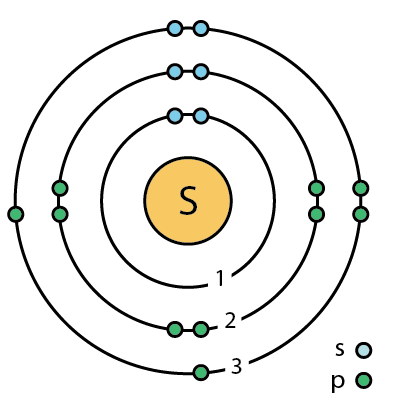
ilustracja Wikipedysta Ahazard.sciencewriter, licencja CC BY-SA 4.0
- P. M. May, D. Batka, G. Hefter, E. Königsberger, D. Rowland (2018) Goodbye to S2− in aqueous solution Chemical Communications 54, 1980-1983, doi:10.1039/C8CC00187A
Komentarze
nieistnienia wodnego jonu siarczkowego nie da się udowodnić
Wiadomo, że dowodzenie nieistnienia czegoś jest nienaukowe i bez sensu, to po co w ogóle (na naukowym blogu) kolejny raz o tym wspominać?
Jeżeli przypuszcza się albo wręcz twierdzi, że coś jednak istnieje, to należy dążyć do udowodnienia tego istnienia. I skoro się to nie udaje, to dobrze jest poinformować o kolejnej próbie i jej wynikach.
I za to dzięki.
Jeśli nie napotkano dotąd wolnego jonu siarczkowego, ale udowodniono, że powstaje jon NaS–, to znaczy, że jon siarczkowy nie ma szans na samodzielne zaistnienie w roztworze alkalicznym i szlus.
I niech kolejny ktoś próbuje kombinować nad następną próbą.
A propos ilustracji
Czy to model atomu siarki z elektronami różniącymi się spinem?
Co oznaczają literki s i p?
@Markot
„s” i „p” to sa nazwy orbitali.
Orbitale sa funkcjami opisujacymi prawdopodobienstwo znalezienia elektronu.
to co narysowane to bardziej ideowa reprezentacja obsadzenia orbitali.
siarka jest w tej samej grupie ukladu okresowego co tlen i ma podobne wlasciwosci
chemiczne
ale anionu O(2-) w wodzie (cieczy) tez sie nie obserwuje!
Energia przylaczenia elektronu nazywa sie electron affinity
X + e– → X– + energy Affinity = – ∆H
affinity to inny proces niz jonizacja czyli oderwanie elktronu.
Drobna uwaga nie mylic prosze tlenu atomowego z tlenem atomowym.
Dane ponizej sa dla tlenu atomowego
Przylaczenie pierwszego elektronu do atomu tlenu jest egzotermiczne.
Stad znak minus.
Electron Affinity of Oxygen is -141 kJ/mol.
ale drugiego electron affinity jest endothermiczne
O−(g)+e→O2−(g)
E=+744 kJ/mol zalezy kogo pytac 🙂
dla siarki
electron affinity dla pierwszego electronu wynosi -200 kJ mol‑1.
danych dla przylaczenia drugiego nie znalazlem.
Byc moze eksperymentalnie i energetycznie tego sie zrobic nie da.
Podejrzewam, w przypadku tlenu, gdyby bombardowac cryogeniczne zamroziona alkaliczna probke wody elektronami to troche jonow elektronegatywnych O(2-) by sie znalazlo ale z pewnoscia w bardzo bardzo malych ilosciach.
Ale to inny proces w ciele stalym a nie cieczy.
A jak z siarka?
…
100% wilgotnosci i temperatura o szostej rano byla 28 deg C. Zdechnac mozna!
* Drobna uwaga nie mylic prosze tlenu atomowego z tlenem molekularnym
Dzięki za poprawkę, bo już zacząłem mylić 🙄 😉
Nazbierałem kurek.
@Markot
– czy wiesz jak w tym edytorze wprowadzac subscripty i superscripty?
Probowalem copy – paste ale nie dziala
@R.S.
Nie mam pojęcia.
Mnie też nie wyszło skopiowanie jonu.
Ale Panek wie, bo robi.
23
NaS-
Na+
Za nisko 🙁
C2H5OH
Hunting high and low – ale to działa tylko z poziomu administracyjnego
Wprowadze w html najwyzej sie zmoderuje
Sprawdzamhigh and low – moze sie uda bez poziomu administracyjnego
Jeżeli zgodnie z zasadami htmlu były trójkątne nawiasy, to najwyraźniej je wycina, zanim się zapisze.
No właśnie, tylko z poziomu administracyjnego 🙄 Tak przypuszczałem.
Bo „zwyczajny” html z sup w nawiasach trójkątnych nie działa.
html tez nie dziala, trudno 🙁
Wiatr dziala mi na nerwy, bo juz juz zew morza czuje, i kosci bolace tez by sie chetnie poruszaly, a tu masz wiatr zdechl, wiec napisze troche o ladunkach dokladanych do molekul.
Cofnijmy sie do konca lat osiemdziesiatych zeszlego wieku.
Otoz niektorzy pewnie pamietaja zimna fuzje jadrowa.
Dwoch naukowcow z Utah oglosilo swiatu, ze potrafia dokonac fuzji nuklearnej za pomoca elektrolizy wody na elektrodach platynowych a moze to byly palladowe.
Tak sie akurat sklada, ze wydzielany wodor podczas elektrolizy czesciowo rozpuszcza sie w takich elektrodach, i tam sie kumuluje.
Kumulowali, kumulowali za im dupnelo.
Dupniecie zostalo ogloszone Swiatu jako wielki sukces chemikow i ogloszono go jako zimna fuzje jadrowa. Jako wytlumaczenie dupniecia podano sciskanie wodoru w sieci krystalicznej metalu elektrody.
Ale nie bardzo potrafili wyjasnic dlaczego nie zarejestrowali neutronow.
Gdyby naukowcy byli bardziej zaznajomieni z assocjacja ladunkow to do kompromitacji by nie doszlo.
Wyjasnienie ponizej:
Reakcja wodoru (molekularnego) czyli dihydrogen z protonem jest bardzo egzotermiczna. Protony ( a raczej forma solwatowana H3O+) w roztworze w pewnym momencie zaczely reagowac
H2 + H(+) -> H3(+) + (energia wiecej niz -300kcal/mol)
Zadnej fuzji jadrowej nie bylo, byla za to niekontrolowana reakcja chemiczna!
Akurat, fakt ze tam i tu wciaz podaje sie S(2-)aq swiadczy o tym, ze nie wszyscy chemicy akurat znaja chemie fizyczna.
Skroty w mysleniu i jak widac z powyzszego moga powodowac niespodzianki interpretacyjne.
Podobny przyklad blednej interpretacji wygarnolem projektodawca oczyszczalni wody morskiej. W tym konkretnym przypadku w analizie wplywu na srodowisko pominieto proces redukcji siarczanow w warunkach beztlenowych.
-> RESPONSES TO COMMENTS IN THE FINAL EIR/S for the California American Water Company (CalAm) Monterey Peninsula Water Supply
Kociolka wegla nie rozpalam, bo siec energetyczna i tak ledwo zipie przy tym upale, wiec za bledy wybaczcie.
@Piotr Panek
nieistnienia wodnego jonu siarczkowego nie da się udowodnić, podobnie jak nie da się udowodnić nieistnienia Boga, krasnoludków czy czajniczka Russela.
@markot
Wiadomo, że dowodzenie nieistnienia czegoś jest nienaukowe i bez sensu
Chyba przesadzacie. Nie da się zaobserwować nieistnienia X, bo nie istnieje obiekt „brak X”, nadający się do obserwacji. Natomiast da się udowodnić nieistnienie X – jest to możliwe co najmniej w odniesieniu do zdań egzystencjalnych o istnieniu X we wskazanym miejscu i czasie. Jeśli przejrzę skończoną liczbę obiektów w pomieszczeniu, w którym teraz jestem i ustalę, że żaden z nich nie jest Juliuszem Cezarem, to jednocześnie dowiodę, że w pomieszczeniu, w którym (teraz) jestem, nie istnieje (teraz) Juliusz Cezar.
Kłopoty z „dowodzeniem nieistnienia” powstają w odniesieniu do zdań tzw. czysto egzystencjalnych („istnieje X”, bez wskazania kiedy i gdzie). No i nawet niektóre zdania czysto egzystencjalne dają się obalić, np. jeśli są sprzeczne z zakazami fizycznymi.
Miłośnik zdania egzystencjalnego może podważać jego obalenie na różne sposoby, np. „nie przekonasz mnie, że w tym pomieszczeniu nie istnieje Juliusz Cezar; może on istnieje, tylko jest niewykrywalny”, „nie przekonasz mnie, że nie istnieje euklidesowy trójkąt o sumie kątów 217°; może on istnieje, tylko jest po prostu sprzeczny”, „nie przekonasz mnie, że nie istnieją cząstki o ściśle określonym położeniu i pędzie; może one istnieją, tylko fizycy są zwyczajnie głupi”. No ale wtedy mamy do czynienia z przekonaniami, z którymi się nie dyskutuje (i które zresztą mogą jednakowo odnosić się do istnienia, nieistnienia i w ogóle do czegokolwiek).
W tej hostyi jest Bóg żywy, choć zakryty, lecz prawdziwy…
Istnieje, a jest obecny…
Jeśli gdzieś jest, to istnieje, tylko trzeba znaleźć to gdzieś 😎
Juliusz Cezar chwilowo wyszedł, a Miss Otis regrets she’s unable to lunch today
https://www.youtube.com/watch?v=Aw1tN0Sm4Rw
@markot
#parser „Miss Otis regrets she’s unable to launch today”
https://i0.wp.com/www.militaryfactory.com/armor/imgs/bm13-katyusha_4.jpg
Czy istnieje jakaś definicja istnienia? To poproszę, bo się trochu gubię z protonami, neutronami i jądrami Cezara.
@Gammon
😆
@jcp
Sprecyzuj (zdefiniuj?), o jaką definicję ci chodzi?
Realną czy nominalną?
Równościową (klasyczną czy nieklasyczną) czy nierównościową (indukcyjną, słownikową, filologiczną)?
😉
Definitio fit per genus proximum et differentiam specificam.
@Gammon
A, dlaczego miałabym gościć u siebie akurat Juliusza Cezara?!
Krocząc śladami za siarka i jej kopalniami, dotarłabym do Meksyku, przyjmując
że mamy okolice listopada nie lipca, „L” w ta czy tamtą trafiłabym akurat na
Dia de los Muertos…
https://www.youtube.com/watch?v=WEeFtmQAGTA
Choć i przyszedł mi nagle do głowy…Szewczyk Dratewka, czy nie mógłby być tu ze mną(?) gdzieś z mojego domu unosi się siedemset siedemdziesiąt siedem schodów, za nimi jest siedmioro drzwi, siedem możliwości, może już po siódmych urodzinach albo tych siedemdziesiątych….
W Dia de los Muertos… mile byłby widziany ktoś z ołtarza na sercu, w sercu nie z Wikipedii?!
@jcp
Czy istnieje jakaś definicja istnienia?
„Istnieć realnie” = mniej więcej „być sobie gdzieś w czasoprzestrzeni”.
„Istnieć” z innymi określeniami – to już co innego. Trójkąt nie istnieje realnie, więc można najwyżej powiedzieć, że istnieje „jakoś inaczej”.
Ingarden coś tam o tym sporo pisał.
bo się trochu gubię
Chodzi o to, że cząstki elementarne to takie nie-wiadomo-cosie, co to nie wiadomo gdzie, kiedy, jak ani z kim?
@Bohatyrowiczowa
A, dlaczego miałabym gościć u siebie akurat Juliusza Cezara?!
To jest jakby inne pytanie.
Zresztą można zastąpić Juliusza Cezara kimkolwiek innym. Wówczas pojawi się problem, po czym odróżnić nieistnienie („w tym pomieszczeniu, teraz”) Juliusza Cezara od nieistnienia („w tym samym pomieszczeniu, teraz”) Johna Lennona, Helmutha von Moltke albo Kuby Rozpruwacza.
Gammonie, rozroznij nieistnienie od nieobecnosci..
@karat.
rozroznij nieistnienie od nieobecnosci
W zbiorze Z nie istnieje element e – w zbiorze Z nieobecny jest element e – to robi jakąś różnicę? Na moje wyczucie – nie.
Albo inaczej: „w warstwach czerwonego spągowca nieobecne są łupki miedzionośne” – „w warstwach czerwonego spągowca nie istnieją łupki miedzionośne”. Też nie widzę różnicy.
Różnica może być w jakimś szczególnym ususie, np. „uczeń X jest dziś nieobecny” (choruje? wagaruje? pojechał na pogrzeb ciotki?) – „uczeń X dziś nie istnieje” (istniał do wczoraj? zaistnieje jutro?).
P.s. Nie w każdym kontekście można sobie jedno zastępować drugim. Niemniej kiedy mowa o jednej, konkretnej próbce czegoś, czy też o różnych, abstrakcyjnych próbkach czegoś , można zastępować „w próbce X-a nie istnieje Y” przez „Y jest nieobecny w X” – „Y nie jest obecny w X” – „w X nie ma Y” – „Y nie występuje w X” – „Y nie znajduje się w X” i podobne.
@Gammon No.82
„Chodzi o to, że cząstki elementarne to takie nie-wiadomo-cosie, co to nie wiadomo gdzie, kiedy, jak ani z kim?”
Aha, znałem kiedyś taką jedną. W końcu rzuciłem w cholerę. Od dawna dla mnie nie istnieje!
Gammon
W zbiorze Z nie istnieje element e – w zbiorze Z nieobecny jest element e – to robi jakąś różnicę?
Mozna budowac twierdzenia mniej lub bardziej precyzyjnie… Pierwszy przyklad dla mnie jest przykladem metnej terminologii, z wyjatkiem specyficznym wypadkow w ktorych chcesz twierdzic np ze w zbiorze Z e nie moze zaistniec. Drugi – jesli e nie ma w zbiorze Z to nie znaczy ze nie ma jej w innym (nieobecnosc trojki w zbiorze Z nie jest twierdzeniem o jej nieistnieniu).
„Trójkąt nie istnieje realnie, więc można najwyżej powiedzieć, że istnieje „jakoś inaczej”
Trójkąt istnieje realnie jako cecha (właściwość).
(Przewaznie okresla co dany zbior zawiera lub nie zawiera, przynajmniej w tym co ja znam).
Istnienie konceptow, liczb, konstruktow logicznych, idei, wierzen – chyba istnieja jako takie… Na upartego mozna powiedziec ze istnieja jako jakies zespoly dzialajacych neuronow.
Gammon re:P.S.
Chodzilo mi o to ze nieistnienie jest inna cecha niz nieobecnosc (pierwsze zawiera drugie ale nie na odwrot), to nie synonimy, choc masz racje ze w konretnej probce to wychodzi to samo.
Gammon
Przyklad w ktorym nawet w konkretnej probce to nie to samo: powiedzmy ze mamy zbior Z zawierajacy liczby 1,2,3, i jakis algorytm ktory dodaje do zbioru dodatkowe liczby. Wiec nawet jesli liczby 4 nie ma w nim na poczatku, moze byc pozniej.
Życie jest formą istnienia białka, tylko w kominie coś czasem załka…
karat.
21 lipca 2020
14:04
ja bym powiedzial nawet mocniej, neurony to jedyna domena gdzie istnieja nawet bez upierania sie.
Kiedys zadalem pytanie trenerowi delfinow;
czy dostrzega u nich jakies wyzsze abstrakcyjne myslenie.
Odpowiedzial tylko wtedy gdy delfin widzi rybe w reku trenera 🙂
@All
W chemii jest pelno koncepcji upraszczajacych.
Kekulé zobaczyl tanczace malpy, a po latach okazalo sie, ze elektrony w pierscieniach aromatycznych sa zdelokalizowane.
https://en.wikipedia.org/wiki/File:Historic_Benzene_Formulae_Kekul%C3%A9_(original).png
Pewnie mu teraz glupio ze wstydu.
R.S.
Mam wrazenie ze mocno nie doceniamy inteligencji zwierzac, i w Twoim przykladzie problemem jest ile moze zobaczyc trener, nie co pomyslec delfin 🙂
@karat. 21 LIPCA 2020 17:02
Pelna zgoda!
Konwersacja z papugiem Alexem tego dowodzi.
Ale ponoc cos bylo kwestionowane w jego treningu izachowaniu.
https://www.youtube.com/watch?v=ldYkFdu5FJk
moze lubil ryby 🙂
@Panek et al
Powracajac do tematu siarczkow.
Wodny H2S
H2S bardzo slabo sie rozpuszcza w wodzie minimalna rozpuszczalnosc w temp t 200 °C (1 atm, mole fraction (H2S + SH- + S2-) = 0.0005; mole fraction w temperaturze 0 °C and 25 °C wynosi 0.00375 oraz 0.0019 ; czyli podobnie jak gazy nie polarne np tlen, azot. W wodzie zachowuje sie jak slaby kwas
Stala dysocjacji kwasowej (pomiar kwestionowany!) pKa2 mowi ze stezenie S2- w roztworach wodnych mozna pominac.
H2S + H2O equilibrium arrows SH- + H3O+ pKa1 = 6.98 (25 °C) b
SH- + H2O equilibrium arrows S2- + H3O+ pKa2 = ~17 (25 °C) c
jesli pKa2 istotnie jest tak mala w podanych warunkach to faktycznie S2- w warunkach alkalicznych bedzie poza detekcja.
Dla zainteresowanych np skad wiemy ze w wodzie mamy H3O+ a nie H+
Widmo tego jonu jest obserwowalne w podczerwieni.
https://www.nrcresearchpress.com/doi/pdf/10.1139/v57-160
@Gammon
„Zresztą można zastąpić Juliusza Cezara kimkolwiek innym. Wówczas pojawi się problem, po czym odróżnić nieistnienie („w tym pomieszczeniu, teraz”) Juliusza Cezara od nieistnienia („w tym samym pomieszczeniu, teraz”) Johna Lennona, Helmutha von Moltke albo Kuby Rozpruwacza.”
Hm, niezły roztrzask postaci…
Czy „w tym pomieszczeniu teraz” jest ktoś jeszcze…
Obecność to tez nastawienie, po pierwsze:
https://www.filmweb.pl/video/Zwiastun/Wzg%C3%B3rza+maj%C4%85+oczy+Zwiastun+nr+1-16094
Tu kuksaniec za Kube Rozpruwacza, taki lekki, nieobecność ślepi na wzgórzach Nowego Meksyku (swoja drogą – przepięknego) widziałam tylko raz w życiu,
i nigdy więcej, w zwiastunie z wyżej, od 1:42 czujesz obecność kanibala, przeszywa cię, chcesz porzucić skórę i wiać, albo móc dać radę sama siebie kropnąć, bo to bydle czujesz!
Nie istnieje, niby go nie ma namacalnie a jednak jest..
Tutaj( po drugie):
https://www.youtube.com/watch?v=u_VsvZmIWxY
Od tego przeboju zaczynając, ” Blue On Black”tyż wymiata, posłużę sie i tu głosem
wokalisty Ivana Moody, jego baryton( chyba liryczny, porównywałam z głosem
Thomasa Allena, śpiewaka operowego) gość pojęcia nie ma, że choć namacalnie go nie uwłaczysz, ale browarka z tobą wyżłopał, choć może i dzień był do doopy
jego głos ci go wynagradza, zamykasz ten dzień z nadzieją, jakąś tam tak po prostu…
markot
21 lipca 2020
1
„Sprecyzuj (zdefiniuj?), o jaką definicję ci chodzi?
Realną czy nominalną?
Równościową (klasyczną czy nieklasyczną) czy nierównościową (indukcyjną, słownikową, filologiczną)?”
Jakąkolwiek.
@jcp
Z cyklu „Czy widział pan elektron?”
https://naukowy.blog.polityka.pl/2007/03/16/byt-a-niebyt-oto-jest-pytanie/
markot
22 lipca 2020
Z cyklu „Czy widział pan elektron?”
https://naukowy.blog.polityka.pl/2007/03/16/byt-a-niebyt-oto-jest-pytanie
No cóż, prosiłem o definicje, a nie – hamletyzowanie. Jak na razie zakladam zatem, że taka definicja nie istnieje. Ergo: nieistnienie jest to cecha definicji istnienia. Istnienie zaś jest zaprzeczeniem nieistnienia, jak wyżej.
Co zas do elektronu, to widziałem. Całkiem sporo – fajną biżuterię sie z tego robi.
@karat.
Mozna budowac twierdzenia mniej lub bardziej precyzyjnie…
Dopóki mowa o czystym rachunku zbiorów, najlepiej jest zapewne używać zwrotów „X należy do zbioru”, „X jest elementem zbioru”, „[podzbiór] zawiera się w zbiorze”. Ale kiedy zaczyna się mówić o zbiorach obiektów realnie istniejących lub nieistniejących lecz możliwych, lub „być może możliwych”, lub „być może możliwych w innych, dających się pomyśleć wszechświatach”, precyzja nie jest aż tak potrzebna. Każdą wypowiedź można doprecyzować, a próba formułowania a limine wypowiedzi ultraprecyzyjnych może doprowadzić do stuporu i niemożności wypowiedzenia (u mnie tak jest, lampy mi się wtedy grzeją).
@jcp
Aha, znałem kiedyś taką jedną. W końcu rzuciłem w cholerę. Od dawna dla mnie nie istnieje!
Brzmi jak opis nieudanego związku dwóch jednakowych ładunków elektrycznych. Hoc erat in fatis.
@Bohatyrowiczowa
Hm, niezły roztrzask postaci…
Starałem się, żeby tak było.
Czy „w tym pomieszczeniu teraz” jest ktoś jeszcze…
Ktoś wykrywalny.
Obecność to tez nastawienie, po pierwsze:
A tu pogrążamy się w wieloznacznościach. „Nastawienie” może mieć znaczenie dla obecności w sensie przenośnym („obecny ciałem lecz nieobecny duchem” – „od dziś jestem dla ciebie nieobecny”). Zdaje się, że dawniej można było mówić zamiennie „obecny” i „przytomny” – teraz to drugie słowo jest zarezerwowane raczej dla skali Glasgow.
Gammon No.82
22 lipca 2020
16:18
„@jcp
Aha, znałem kiedyś taką jedną. W końcu rzuciłem w cholerę. Od dawna dla mnie nie istnieje!
Brzmi jak opis nieudanego związku dwóch jednakowych ładunków elektrycznych. Hoc erat in fatis.
”
Juz raczej: similia similibus curantur
Fizyczna analogia też chybiona: dwa ładunki odpychają się wzajemnie, a tamta na mnie leciała.
@jcp
Fizyczna analogia też chybiona: dwa ładunki odpychają się wzajemnie, a tamta na mnie leciała.
O.k., zatem nic fizycznego, czysta biologia ewolucyjna.
@jcp
Jak na razie zakladam zatem, że taka definicja nie istnieje. Ergo: nieistnienie jest to cecha definicji istnienia. Istnienie zaś jest zaprzeczeniem nieistnienia, jak wyżej.
Ależ proszę pozostawać przy swoim założeniu do upojenia. Kto powiedział, że każdy termin ma zostać zdefiniowany?
Gammon
Gdy wymyslasz jakis zbior matematyczny, okreslasz co w nim jest i jakie reguly w nim dzialaja, tworzysz jakby mini-wszechswiat, i rzeczywiscie czego w nim nie stworzyles to nie istnieje. Ale ogolnie, poniwaz oboje lubimy brzytwe Ockhama, warto byc oszczednym i nie obiecywac wiecej niz sie musi, a nieobecnosc to cecha skromniejsza niz nieistnienie.
@jcp
Jest definicja istnienia bytow fizykalnych. Byt fizykalny istnieje jesli mozna go wyczuc (to detect) i eventualnie wymierzyc jakimkolwiek przyrzadem. Jesli nie, to (przynajmniej until proven otherwhise) nie istnieje.
otherwise
„znałem kiedyś taką jedną.”… mogę prosić o rozwiniecie, znać taką, jak ona sama siebie poznać do końca nigdy nie pozna!?
„rzuciłem w cholerę” yyy jak to sie robi gdzie chwyta, jak podrzuca , gdzie trafia,
a ta cholera to jakaś ksywa?!
„. Od dawna dla mnie nie istnieje!” można od dawna chcieć zapomnieć ale wymazać, sie nie da!
i miód dla mego wzroku, choć wyczerpanego: ” a tamta na mnie leciała.”
Jakieś objawy: ból kostek, kolan, zawroty głowy, może używałeś zbyt lepnych perfum, albo…lecieć – eh
@Gammon
„Czy „w tym pomieszczeniu teraz” jest ktoś jeszcze…
Ktoś wykrywalny.”
Wykręcę sie i tu zmęczeniem ale i pogrążę, wiesz że mamy dwa psy,
potrafią wpaść mi do łóżka już po godzinie 5, liżą mi twarz, włosy, prowadzą kontrole sanepidowską wręcz mojej skóry za uszami, bo chcą wyjść…
Ale i wpadają inaczej , niby tak samo ale atakują coś za mną, warczą, szczekają,
w końcu młodsza płacze, przywołuje je pytając „co jest?” czy ktoś tu jest?”
nie odpowiadają, ide z nimi po rozum do głowy do łazienki, ale wracają przede
mną , wskakują do wyrka rozkładając sie na poduszkach, jest po sprawie, ale mi jest jakoś tak…:(
@Gammon
„„obecny ciałem lecz nieobecny duchem” ”
Bywam i taka przy zmywaniu, zamaczam naczynia automatycznie, myję, pewnie jakbym obliczyła ile ruchów przy tym wykonuje, to wyszłoby po trzy na każdą
część szklanki, talerza itp macham łapkami, a głowa…pól biedy jak nie mam dola
gdy jest co zaplanować, o czym myśleć, jakieś pozytywy…
Myślę, że mogę też być tylko obecna duchem, ciałem wtedy ledwo, to są miejsca w których być nie chcę albo bliskość osób, od których chce uciec, wtedy mnie tam nie ma…
Nastawienie…Gammon zdarza sie rzadko ale zdarza, że słyszę nawoływanie,
mój brat jako jedyny do końca zwracał sie do mnie z ksywy, „Siwa” słyszę zawsze w kuchni, gdzie siedzieliśmy nocami, gdy dzieciaki spały, on pykał fajeczkę, coś tam sobie popijaliśmy, a On mi opowiadał gdzie był, co widział itd
Nieobecny – nieistniejący a zabiegający o uwagę…nie wiem
„„od dziś jestem dla ciebie nieobecny”
a tego kategorycznie Ci zabraniam! 🙂
@karat.
Ale ogolnie, poniwaz oboje lubimy brzytwe Ockhama, warto byc oszczednym i nie obiecywac wiecej niz sie musi, a nieobecnosc to cecha skromniejsza niz nieistnienie.
Mnie się zdaje, że oszczędność zezwala niekiedy na nieprecyzyjność, czy wręcz ją usprawiedliwia. Dystynkcje między pojęciami tylko czasem są potrzebne w danym momencie .
@Bohatyrowiczowa
Ja tylko o przykładach uzusu językowego.
@Panek
-> prawdopodobny obraz reakcji wygląda nie tak, jak podałem wyżej, lecz tak:
HS– + OH– + Na+ NaS– + H2O
Czyli atom siarki, który mógłby tworzyć jon siarczkowy, od razu jest przechwytywany przez atom sodu.
Poprosilem przyjaciela (J.Ch.) o opinie, ktory jest duzo lepszym chemikiem niz ja. Obiecal przeliczyc sprawe metodami chemii kwantowej.
Postawil inna hipoteze , bardzo ciekawa!
Swoja droga, to H2S z realiami zycia sie tu w dyskusji zatracil???
A szkoda, bo H2S jest przyczyna trucia ogromnych ilosci ryb.
Patrz -> fish kill w Namibii
https://www.namibian.com.na/public/uploads/images/58ae6b56e0f1a/1fishdieoff-2102wk-23.jpg
@R.S.
„Swoja droga, to H2S z realiami zycia sie tu w dyskusji zatracil???”
Nie od dziś wiadomo, że rzeczywistość wcześniej czy później zaskrzeczy. Już tak ma.
A moją drogą, nie sądze, aby świadomość tego, iż atom siarki jest przechwytywany przez atom sodu stanowiła jakieś specjalne pocieszenie dla ogromnych ilości nieszczęsnych ryb z Namibii.
@jcp
… aby świadomość tego, iż atom siarki jest przechwytywany przez atom sodu …
bez zrozumienia podstaw naukowych, nie potrafimy dokonac wlasciwej kwantyfikacji procesow.
Ale jak polaczyc nauke ze swiadomoscia spoleczna to bardzo trudne
Cornelis van Niel 1931
2 H2A + CO2 → 2A + CH2O + H2O
A=O
A=S
@Slawomirski
Czy Cornelis van Niel to wcielenie TEGO SAMEGO co zamieniał wodę w wino ale w kolejnym wcieleniu mu nie wyszlo i zamienil w formaldehyd?
… i ze względu na szybką fermentację stosował siarczki do przerwania procesu.
Niestety chyba się starzeje i nie rozumiem dowcipu, ale wiem jedno po siarczkach na drugi dzień strasznie głowa boli.
Please elaborate.
Cornelius van Niel wpadl na pomysl ze chemiczne podobienstwo H2S i H2O w procesie fotosyntetycznym sugeruje wodne a nie dwutlenkoweglowe pochodzenie tlenu atmosferycznego.
W 1941 roku izotop tlenu O18 stal sie dostepny bezapelacyjnie dowodzac ze tlen atmosferyczny pochodzi z wody a nie dwutlenku wegla.
Genialna obserwacja Corneliusa van Niel
CO2+2H2S>(CH2O)+H2O+2S
wskazala ze fotosyntetyczne bakterie uzywajace H2S i CO2 do produkcji cukrow nie wydzielaly tlenu. Dlatego tlen atmosferyczny nie mogl pochodzic z CO2.
Czyz nie lepiej teraz sie wszyscy czujemy wiedzac ze wdychamy tlen czasteczkowy pochodzacy z czystej wody a nie wstretnego dwutlenku wegla ktory nie jedna kapusciana ekologiczna glowe ma na sumieniu.
Historia o tym, dlaczego wolę siarkowodór niż nowy samochód zony.
Zona jakiś czas temu zorganizowała mi wizytę u lekarza.
Trudno wszyscy rdzewiejemy i czujemy się jak stare tramwaje, które nie mogę rozprostować pantografów. Poddałem się.
Lekarz kazał utoczyć krwi.
Podczas wizyty, gdy pojawił się w iPadzie, zmarszczył czoło i powiedział:
Rozumiem ze odmawia Pan spożywania czegoś tam!
To coś mimo starań marketingu amerykańskiego już nazwę miało odpychająco wymiotną, a z pewnością powoduje impotencje intelektualną i nie tyko.
Na zakończenie wizyty, widzac ze jestem uparty, na złość wysłał mnie do drugiego lekarza.
…
Tu nastąpi retrospekcja.
Ostatnio, czyli dwadzieścia lat temu, gdy teściowa przekonała córkę ze z pewnością toczy mnie jakaś straszna choroba, Pan doktor chciał mi jak sęp skubać wątrobę. Ale się nie dałem ani teściowej ani specjaliście!
Ostatecznie wyszło na moje. Jak rura wodociągowa ze studni została wymieniona to i nadmiar żelaza z mojej krwi zniknął, zreszta zony tez.
Pan doktor był poruszony bo szykował donos, ze genetycznie z zona jesteśmy spokrewnieni, co miało wytłumaczyć u nas obojga affinity do żelaza.
…
W dzień wizyty, czyli dzisiaj, stwierdziłem, ze wezmę żony nowiutki samochód.
Po pierwsze mój śmierdzi siarkowodorem – powodem nieprzyjemnych doznań węchowych jest woda morska skapująca z pianki, harness-u oraz żagli, niefortunnie prosto w tapicerkę.
Po drugie zona mówi, ze to wstyd czymś takim jeździć do ludzi.
…
Kiedyś żona nie wytrzymała i posprzątała, gdy musiała przewieźć siostrzenicę wraz przychówkiem oraz wózkiem dla dziecka z lotniska. W jej samochód jakoś nie mogli się zmieścić. Mimo wysiłku zony, na koniec transportacji siostrzenica spytała, a czy wujek to ten samochód w ogóle sprząta?
Od tego czasu zonie siarkowodór nie przeszkadza, nie przewozi siostrzenicy.
Sama tez do !MOJEGO! samochodu jakoś nie chce posprzątać ani do niego wsiadać.
…
Po trzecie nie będę stresował zaprzyjaźnionego pająka. A ze ozonuję wnętrze samochodu, po wypadach do miasteczka, to tri-oxygen O3 mógłby mojemu przyjacielowi zaszkodzić.
…
Nowiutki samochód zony (przebieg cztery tysiące nielegalnej miary długości), po przejechaniu pięciu mil, wyświetlił, ze wpadam w poślizg!.
Poranek dnia dzisiejszego był gorący i suchy, taki przyjemny, ze pot-koszulek gdybym go miał by spłynął.
Asfalt jeszcze nie zdążył się rozpuścić, wiec czemu ten pieluchowiec narzeka?
Mimo wycia, „baby” dojechało na parking, z tym ze był to zły parking, czyli kosztowny. Ksztowny bo bardzo lubiany przez lokalną policje, która ma kłopoty finansowe.
Niewiele myśląc wrzuciłem wsteczny, „Baby Mazda” odmówiło.
Baby w dodatku było uparte i nawet na luzie nie dało się ruszyć.
No i się zaczęło…
Ciąg dalszy tylko na żądanie czytelników bloga.
…
@R.S.
Jak dla mnie rewelka, i ja bym chciała cdn 😀
Zdradzisz czym to Ty sie poruszasz z plaży na posesję?!
Wewnętrznie, pomyślałam o UAZ 469 B, pasowałyby do Ciebie
i niechęć do bagażnika na żagiel i deskę byłaby usprawiedliwiona…
Ta „Baby Mazda” to coś z tych tutaj z Sin City?:
https://www.youtube.com/watch?v=sXYIxJScSik
Zanosi sie na łobuzerkę z tą Baby, dlatego coś w tym klimacie (clip nie dla żon)…
@R.S.
Lekarz (…) zmarszczył czoło i powiedział:
Rozumiem ze odmawia Pan spożywania czegoś tam!
To coś mimo starań marketingu amerykańskiego już nazwę miało odpychająco wymiotną, a z pewnością powoduje impotencje intelektualną i nie tyko.
Filboid Studge?
http://www.eastoftheweb.com/short-stories/UBooks/FilStu.shtml
@
R.S.
Głowa boli nie od siarczków w winie, a od histamin – mówią fachowcy.
Skąd siarkowodór w wodzie morskiej?
To raczej beztlenowo gnijące w twoim samochodzie resztki planktonu i wodorostów.
Przywoziłem już znad morza różne muszelki, które okazywały się niezupełnie czyste i wolne od mieszkańców, co sygnalizowały (po jakimś czasie) właśnie przykrym zapachem zgniłych jaj.
Baby Mazda z technologią Skylink, ponoć powinno samo z siebie poinformować serwis pomocy drogowej, ze mu cos dolega. Ale nie poinformowało.
Biegnąc przez parking, zadzwoniłem do zony.
Kochanie zrób cos! Masz wielokrotne doświadczenie.
Baby Mazda 5 zostało nabyte jako upgrade, gdy poprzednia Mazda 3 została zgarażowana przez złoczyńcę na autostradzie.
Po tym incydencie zona stwierdziła ze Baby musi być większe, ze jak ktoś jej przypieprzy to tez niech poczuje.
…
Lekarz, po zmierzeniu ciśnienia, zaczął straszyć.
Spytał, czy jestem aktywny???
Na wszelki wypadek poprosiłem, aby powtórzył pytanie.
No … czy uprawia pan sporty?
Uprawiam.
A jak często?
Jak wiatr wieje.
…
Wróciłem do samochodu.
Mandatu za wycieraczką nie było.
Dzwoni zona.
– Musisz zadzwonić sam, bo serwis musi zlokalizować samochód.
A gdzie mam dzwonić? Nie mam numeru.
Zona
No powinien być.
Próbuje dzwonić.
iPhone zamiast pokazać klawiaturę, upiera się aby polaczyc się z samochdem.
Po czym oferuje mi opcje odsłuchowe muzyki.
Cale szczęście, ze to parking a nie autostrada przechodzi mi mysl przez glowe.
Po kilku próbach wreszcie dzwonie,
W głośnikach automatyczna recepcjonistka przeprasza, i upewnia mnie, ze bardzo im zależy aby ich serwis był uprzejmy ale agenci serwisu są zajęci, po monologu trwającym dobre pol minuty.
Jeśli to jest wypadek i krwawię, to mam zadzwonić na pogotowie.
…
Po kilkudziesięciu sekundach wreszcie pyta jak chcesz to wyślemy Ci link.
-Ja nie chcę linku, ja chcę człowieka, mam już prawie łzy w oczach.
-Cos robi ding ding, pojawia się SMS z linkiem.
-Glosniki dalej gadaja, czy dostałeś link?
Naciśnij jeden, jeśli tak.
Jak mam do cholery nacisnąć gdy klawiatura znikła.
No nic, zamiast tego wciskam link.
Browser otwiera stronę, z ikonami wybierz opcje.
– bateria
-hak
-kanister benzyny
Wybieram hak holujacy,
W tym momencie pojawia się napis uaktualnij browser.
Telefon podłączony do samochodu wciąż gada czy dostales link?
Do cholery, ja chcę człowieka!
Rozłączam się.
Znowu dzwonie, program powtarza dokładnie poprzedni scenariusz.
Za trzecim razem, sztuczna inteligencja mówi, a jak chcesz człowieka to naciśnij gwiazdkę.
Naciskam gwiazdkę!
Klawiatura znikła na dobre, pojawiły się za to icony kontaktów, tylko p[o to aby ułatwić mi życie.
Dobrze, ze kardiolog blisko, myślę sobie może mnie odratują.
…
Za cholerę nie mogę się pozbyć icon. Klawiatury jak nie było tak nie ma!
…
No tak, ja się już wykrwawiłem. Oczyma wyobraźni widzę mego ducha dalej walczącego z udogadniającymi życie opcjami iPhona.
…
Wreszcie rozmawiam z człowiekiem
A jaki jest mój numer komórki?
Nie mając pojęcia, odpowiadam wiec rezolutnie ten sam co ci się wyświetla.
Agentka pyta dalej? To gdzie ja tak właściwie jestem bo ma kłopoty z lokalizacja.
Na końcu języka mam odpowiedz:
Jestem w inteligentnym samochodzie ze sky-linkiem.
Ale nie będę złośliwy, kobieta ma pewnie urwanie głowy, bo przedszkole zamknięte.
…
Skylink nie działa!?
Wyobrażam sobie mnie jako trupa próbującego naprowadzić pomoc, gdzie leży moje ciało.
… zawsze pływam w piance, przynajmniej szybko ciało nie utonie łatwiej będzie znaleźć. Fale na brzeg wyrzuca. Po cholerę komu skylink!
Po cholerę Ona, czyli zona wydala tyle forsy.
…
Sukces, wreszcie dostaje link do strony internetowej, ze zgłoszenie holowania zostało przyjęte.
Pomoc przyjedzie za dwadzieścia minut.
…
Po dwóch godzinach, dzwonie znowu, gdzie ta pomoc?
…
Pomoc drogowa przyjechała i się pyta, czy mam zestaw do holowania?
Co?
No powinien być w bagażniku.
W bagażniku rozpoznałem koło zapasowe i jakieś klucze, ale zestaw jaki zestaw?
Facet machnął ręką.
…
W pełni elektroniczna skrzynia biegów, nie wrzuca luzu! Facet kiwa glowa teraz wszystko elektryczne.
Na szczęście samochód może jechać do przodu.
Udaje się wjechać na platformę pojazdu holowniczego.
…
Wreszcie w domu. Pijemy Merlota bez siarczkow!
…
W nocy obudził nas huk, cos się oberwało.
To była chmura.
…
Zona śmiejąc się biega jak stara hrabina w filmie z garnkami łapiąc strugi wody z sufitu.
…
Ciekawe co sie bedzie dzialo dzisiaj?
@All
dzieki za stymulacje
Life is not about waiting for the storms to pass…
its about learning how to dance in the rain.
Vivian Greene
Zaś mechaniczne nieżycie jest po prostu trwaniem i robieniem tego, co ma być zrobione. Aż do momentu złomowania.
@R.S.
No…(myślę) jest ok, tylko strasznie grzecznie, ja to sobie pstryknęłam kapslem zeróweczki, rozsiadłam, zamiast czytać powoli i sie tekstem rozkoszować, …pałaszując go, szukam mocowanka z niebieskimi o nieprzyjęcie mandatu(?) 🙁
Choć tyci tyci, podniesionego głosu w rozmowie z Agentką, żeby Ci sie chociaż urwało… klasa od do, bateria też nie padła …Ale dryg do pisania masz naukowcu…
i coś dla żon:
https://www.youtube.com/watch?v=Iq9z90oHYVY
(takie dobre bo nasze, polskie!)
@R.S.
„Life is not about waiting for the storms to pass…
its about learning how to dance in the rain.
Vivian Greene”
Gdzieś koło 19 – tej mieliśmy tu burzę,, ulewę, słońce i tęczę, no nie tańczyłyśmy,
ale kręciłyśmy sie w kółko na balkonie, wnuczka za trzy dni skończy 13 miesięcy a już sama chodzi, na tą chwilę najprawdziwsze szczęście w mym życiu to jej śmiech…i to ja chce jej dorównać kroku…oby tanecznie!
@Bohatyrowiczowa – usmiechy 🙂
@Filboid Studge – podobalo mi sie ha ha
@Markot jesli histamina jest w kazdym winie a to z siarczkami mi nie dokucza to jak to mam rozumiec? Na wszeliki wypadek Twoje zdrowie, poki noc mloda.
mnostwo niedorobek i zle sformatowane, ale z zycia wziete
@oraz dla ciekawskich
Baby Mazda postanowilo popsuc sobie cala skrzynie biegow!
O tak, dowcipnie, zeby ludzie mieli co robic.
@R.S.
Siarczki też są praktycznie w każdym winie i to nie tylko z powodu ich dodawania w procesie fermentacji.
Które wino powoduje u ciebie większy ból głowy, białe czy czerwone?
Nietolerancja na histaminy rośnie z wiekiem.
W winach likierowych (porto, sherry) oraz alkoholach dojrzewających w beczkach (calvados, whisky) stwierdzono spore ilości aldehydu octowego, który powstaje także w organizmie jako metabolit etanolu i obarczany jest odpowiedzialnością za „syndrom dnia następnego” czyli kaca.
@markot 25 lipca 2020 8:34
Bialego nie pijam, destylatow tez.
Odczuwam wyrazna roznice miedzy europejskim czerwonym a kalifornijskim.
Wszelkie hiszpanskie, np Rajoha, powoduja ze niewielka ilosc 150ml powoduje reakcje. Podobnie francuskie.
Argentynskie i Chilijskie jest znosne.
Najbardziej odpowiada mi Merlot.
jest dobra winnica we Wloszech. Przy jakis specjalnych okazjach raz do roku, dostaje w prezencie od przyjaciela – papieskie!
Nie mam pojecia gdzie jest roznica w skladzie. Tak jak pisalem na etykiecie europejskich jest napis zawiera siarczki, a w amerykanskich odwrotnie, ze nie ma.
@R.S.
Rajoha?
Masz na myśli hiszpańskie wino rioja czyt. riocha?
Wina czerwone zawierają więcej histamin niż białe.
Deklaracje na etykietkach o niezawieraniu siarczków oznaczają co najwyżej, że wino nie było siarkowane w trakcie produkcji. Wina zawierają siarkę w sposób naturalny, a jeśli nie są siarkowane przed butelkowaniem, to często do konserwacji stosuje się kwas askorbinowy.
Oczywiście jabol z nadgniłych jabłek i nadpleśniałych malin może być przesiarkowany i wtedy w bukiecie dominują tiole.
Histaminy (aminy biogenne) powstają szczególnie w czerwonych winach przechodzących powtórną fermentację w celu redukcji kwasowości.
Wina białe mają na ogół niską kwasowość i wystarczy im pierwsza fermentacja przetworzenia cukru w alkohol.
Markot
-> rioja czyt. riocha? dobrze mowisz dzieki
Ty sie jak pamietam o ile dobrze zrozumialem profesjonalnie zajmujesz takimi procesami?
…ciekawe o tych winach, osobiscie chetnie bym posluchal o oddychaniu wina przed konsumpcja. Jak dlugo czekac?
@R.S.
Mój znajomy na takie pytanie odpowiada: Chcesz to wino pić czy reanimować?
Jeśli wino jest z rocznika, który osiągnął końcowy wiek przydatności do picia, powinno być wypite w przeciągu dwóch godzin, a nadmiar tlenu może mu tylko zaszkodzić. Lać do kieliszka i się delektować. Jeśli na dnie butelki jest osad, zdekantować.
Jeśli jest raczej młode, pełne niezrównoważonych tanin (garbników), to można przelać do karafki o szerokim dnie, poczekać godzinkę i próbować.
Zebrałeś już pewnie sam dosyć doświadczenia i stwierdziłeś przy niektórych winach, że każdy kolejny kieliszek smakuje coraz lepiej, wino traci szorstkość, zyskuje na miękkości i aksamitności, łatwiej „wchodzi”, choć nie jesteś pijany… To może być właśnie zasługa dotlenienia.
Wino „oddycha” lepiej w kieliszku niż w butelce, a jak długo postoi otwarte i nadal nie smakuje, zużyć do coq au vin zanim skwaśnieje i się zmarnuje.
Generalnie, jeśli po otwarciu i nalaniu do kieliszka wino ci smakuje i ma przyjemną „gładkość”, to jest gotowe do picia. Jeśli nie za bardzo, to poczekaj chwilę.
Przede wszystkim jednak sprawdź, czy ma właściwą temperaturę. Nie powinna to być tzw. temperatura pokojowa rzędu 20°C i powyżej.
Dla młodego wina 14-16°C
średnio rozbudowanego 16-18°C
ciężkiego 18°C
Jak rozróżnić? Powąchać.
Im więcej tanin, tym intensywniejszy zapach wina, tym niższa temperatura.
Markot,
przygotowales dobre compedium
dzieki.
-> Jeśli wino jest z rocznika, który osiągnął końcowy wiek przydatności do picia …
znaczy sie wykopaliskowe?
Przed czernobylskich (cez), jakos nie mialem okazji.
Generalnie nie jestem snobem i unikam octu – ha ha
Najstarsze jakie mi sie trafilo w miare ostatnio to z roku 2000, ale nie mialo terminu przydatnosci.
Nawet sie zastanawialem czy moze by tak zakopac, ale pokusa byl zbyt duza.
@R.S.
Tak myślałem, że czepisz się tego rocznika 😉
Jeśli masz jakąś tabelkę (jest ich całe mnóstwo), która podaje informacje o rocznikach win wraz z ich oceną, to tam zazwyczaj jest też informacja, kiedy je najlepiej pić i do kiedy przechowają się bez szkody. Założywszy, że masz optymalną piwnicę lub stosownie temperowaną lodówkę do win.
Wino kupowane w sklepie jest z reguły od razu przydatne do konsumpcji, ale dobre roczniki wykupywane są często dużo wcześniej, gdy cena jest niższa, i leżakowane.
Cena dobrego wina rośnie bowiem wraz z jego wiekiem i popularnością.
Kiedy już do wszystkich dotrze, że np. Barolo z 2007 roku to fantastyczny trunek, spróbuj znaleźć je w sklepach za rozsądną cenę.
Rocznik 2006 przekroczył swój zenit i należy go wypić, rocznik 2012 jest świetny, ale jeszcze za młody, 2010 można już pić i się delektować…
Sam wiek o niczym nie świadczy, a na butelkach nie ma daty przydatności do spożycia.
Kiedyś u znajomych podano z dumą 10-letnie Beaujolais Villages, potworny sikacz, który powinien był być wypity (o ile znalazłby się amator) najpóźniej w trzy lata od produkcji.
Markot,
jako industry insider
to na zakonczenie pytanie.
Czy cena wina pojdzie w gore czy w dol?
Restauracje ida out of business
a z drugiej strony, ludzie siedza w domu i gadaja o winie 🙂
– jak tu planowac na wypadek suchomordzia
Nie jestem industry insider.
Z cenami to na dwoje babka wróżyła. Winiarze skarżą się na pełne piwnice, a tu nowy rocznik za progiem… Można się spodziewać wzmożonych promocji pod koniec lata, ale raczej na rocznik 2018-2019.
Jaki będzie tegoroczny zbiór, to na razie nie wiadomo. Trzeba przeczekać gradobicia
Jeśli masz dostęp do kalifornijskich roczników 2014-15, to podobno są bardzo udane i już do picia, a 2016 też świetny, ale jeszcze może poczekać. 2017 będzie też niczego sobie.
Próbowałeś już innych włoskich szczepów poza merlotem?
Nero d’Avola, Negroamaro, Primitivo (di Salento, di Manduria) to nie są wina do długiego przechowywania, ale nie są drogie i bywają wcale wcale…
A próbowałeś Montepulciano? A sardyńskie, na przykład Canonnau DOC (grenache)
Ochlaptusy
Zamiast delektowc sie genialnoscia naukowej dedukcji Corneliusa van Niel wybieraja rozmowy o kieliszku.
Dobre wino nigdy nie stanowi przeszkody w delektowaniu się genialnością naukowej dedukcji. Wręcz przeciwnie 🙂
In vino veritas
Polscy licealiści właśnie dostają szansę nauczenia się tego zdania (i pewnie niewiele więcej) na proponowanych lekcjach łaciny i kultury antycznej.
Jedna godzina tygodniowo, przy rezygnacji z lekcji wychowania muzycznego i plastycznego. Takie trzy opcje do wyboru.
Przypomina mi się moje małe dziecko, któremu kazałem umyć zęby, a ono rezolutnie:
– Rączki czy ząbki? Co wolisz?
Castel Giocondo, Brunello de Montalcino, Frescobaldi
– rocznik 2013
Coz za bukiet!
Znajomy mowi wode pija zwierzeta a ludzie wino, no i po winie wszystkie kobiety sa piekne. Nadmieniam, ze to cytat, ale na kolege donoscic nie bede.
!!! Dla mnie sa piekne i bez wina !!!
O wodzie nie chce mi sie rozmawiac, no chyba ze przy dzwiekach kobzy.
Ale wtedy to chyba whisky, ktorej nie pijam.
di Montalcino.
Dobre towarzystwo do jagnięciny, gulaszu wołowego…
Frescobaldi swego czasu płacił swoim winem Michałowi Aniołowi za jego dzieła.
A w 2008 roku był zamieszany w skandal fałszowania wina (wraz z innymi producentami), prokuratura zarekwirowała wtedy 700 000 butelek i wstrzymała eksport. Bardzo ucierpiał przy tym image Brunello, bo się wydało, że w celu przypodobania się amerykańskim gustom do moszczu sangiovese dodawano soku merlota i caberneta sauvignon z południa Włoch, co łagodziło smak słynnego wina, ale prawnie jest absolutnie zakazane.
Były też jakieś historie z glikolem z tego samego powodu.
Rocznik 2013 jest do kupienia, od ca 46 euro za butelkę.
Do picia nadaje się do 2030 roku. Nie ma co się spieszyć 😉
Chińczycy, których na to stać, kupują i piją zmieszane z coca-colą.
Markot,
-> di Montalcino. Dobre towarzystwo do jagnięciny, gulaszu wołowego…
!!! Polej to jeszcze sosem z kurek, ktore nazbierales i nas wyrzuca z tego blogu
na swoja obrone chcialem tylko powiedziec, ze wiekszosci nazw win i potraw jakie mi sie przytrafily nie jestem w stanie powtorzyc.
Duzo wazniejsze jest dla mnie towarzystwo, niz co wrzucili na talerz.
…
w czasach korporacyjnych, klopot jak zaplacic rachunki, splywal na ksiegowego firmy. To byly ciekawe czasy, i kultura korporacyjna, ktora raczej nie wroci.
…
Czasem lubie cos upichcic ale jest to nieodtwarzalna receptura, czysto improwizowana i bez nazwy. Zapraszam!
@R.S.
Nazw win nie musisz pamiętać co do joty, ale „de” (of) to jest po hiszpańsku.
Po włosku jest „di”.
Brunello di Montalcino, Primitivo di Manduria
Señorío de Cuzcurrita (rioja), Casa de Campo Cabernet Sauvignon etc.
strasznie sie zdenerwowalem! 🙂
poszedlem sprawdzic, faktycznie na skrzynce i etykietkach jest di.
A juz myslalem, ze jakis Psikuta ( pisane bez s),
jakas podrobke doprawiona glikolem sprzedal.
Poczulem sie zdecydowanie lepiej!
Ten glikol to stara sprawa, afera z Francuzami, byla chyba czterdziesci lat temu?
Potem z owijka szyjek z olowiu.
@ HS– + OH– + Na+ NaS– + H2O
moj serdeczny przyjaciel J.Ch. odpisal ze
asocjacja stężonych elektrolitów jest zawsze bardzo istotna i mechanizm jest prawdopodobnie dobrym przyblizeniemrzeczywistosci
byc moze w roztworze sa rowniez OHSH (-2)
ale aby to dokladnie zbadac zamiast w
Brunello di Montalcino, Primitivo di Manduria
Señorío de Cuzcurrita (rioja), Casa de Campo Cabernet Sauvignon etc.
trzeba by zainwestowac w grant naukowy
@R.S.
Afera z glikolem na dużą skalę była w Austrii w 1985 roku. Od tego czasu wszystkie butelki z austriackim winem muszą mieć numerowane banderole, a kraj ten ma najsurowsze przepisy i kontrole dotyczące produkcji wina.
Niedawno jednak także we włoskim Primitivo Salento IGT 2015 (firma Giordano) stwierdzono ślady glikolu i wycofano go ze sklepów.
W 2010 był proces francuskich oszustów, którzy sprzedali w USA 18 milionów butelek modnego tam bardzo od czasu filmu „Sideways” wina pinot noir, które w rzeczywistości zawierało znacznie tańsze szczepy syrah i merlot.
Jeden z oskarżonych francuskich eksporterów bronił się przed sądem w Carcassonne argumentem, że żaden amerykański konsument nigdy nie złożył reklamacji 😎
A propos włoskich win, to stary toskański winiarz na łożu śmierci wyznał swoim synom, że wino można robić TAKŻE z winogron 😎
@markot 26 lipca 202014:59
Chyba wykrakalem!?
Artykul z NYT 27 lipca,
Francuzi przerabiaja wino na „mydlo” z powodu braku zbytu!
Soon the wine would be sanitizing hand gel.
https://www.nytimes.com/2020/07/27/world/europe/france-alsace-wine-coronavirus.html
Jakie tam „mydło”?
Zwyczajnie destylują, żeby chociaż etanol się nie zmarnował. A ten jest pilnie potrzebny do produkcji środków dezynfekujących. Także żelowych.
W sąsiedniej Szwajcarii dzieje się to samo, tyle że z innych powodów.
Trzymane od lat na wypadek pandemii rezerwy rządowe w postaci 10 000 ton etanolu „rozeszły się” tj. zostały sprzedane wskutek prywatyzacji monopolu spirytusowego. Instytucja, która przejęła od rządu monopol, nie otrzymawszy od państwa nowej umowy na te rezerwy zagospodarowała go czyli upłynniła.
Wprawdzie sprawa, komu powierzyć dbanie o rezerwy etanolu, miała być rozpatrywana przez parlament w tegorocznej sesji letniej, ale w lutym okazało się, że nie ma o czym dyskutować, bo rezerw nie ma.
Na dodatek największy szwajcarski producent środków dezynfekcyjnych dla szpitali w wielu krajach splajtował na krótko przed pandemią, bo był „za drogi”. Teraz wyprzedaje resztki zapasów po cenach, o których nigdy nie marzył w „normalnych czasach”.
-> Jakie tam „mydło”?
przecierz sie smieje, „mydlo” brzmi lepiej niz bimber
rezerwy rządowe … „rozeszły się” – piszesz o Francji czy o Polsce?
bo sie gubie.
u nas tez np Hel sie rozszedl i nie ma do NMR-ow
za to ciekawa sprawa z kryptonem. Nagle maja go za duzo i rozpieprzaja w maszynach do napylania powlok – spattering
krypton pojawil sie na rynku z powodu przejscia w motoryzacji na LED-y